Лечение артериальной гипертензии (гипертонической болезни) ингибитором ренина. Зачем назначают ингибиторы ренина Какой препарат ингибирует ренин
03.07.2012
386 Просмотры
При артериальной гипертензии (гипертонической болезни) количество фермента Ренина в крови увеличено. Это приводит к стойкому и продолжительному увеличению в крови и тканях организма количества белка Ангиотензина 2. Ангиотензин 2 обладает сосудосуживающим действием, способствует задержке натрия и воды в организме, что приводит к повышению артериального давления. Высокий уровень ангиотензина 2 в крови и тканях продолжительное время становится причиной стойкого повышения артериального давления, то есть – артериальной гипертензии. Ингибитор Ренина – лекарственное вещество, которое вступает в соединение с Ренином, в результате чего Ренин нейтрализуется, теряет ферментативную активность. Это взаимосвязано приводит к уменьшению уровня ангиотензина 2 в крови и тканях – к снижению артериального давления.
АТ2 оказывает сосудосуживающее действие, способствует задержке натрия и воды в организме. Это приводит к увеличению и к увеличению объёма циркулирующей крови. Вторично происходит увеличение силы сердечных сокращений. Всё это суммарно становится причиной повышения (АД) как систолического (верхнего), так и диастолического (нижнего). Чем больше уровень Ренина в крови, тем больше уровень в крови АТ2, тем выше АД.
Последовательность ферментативных превращений: Ренин + Ангиотензиноген = Ангиотензин 1 + АПФ = Ангиотензин 2, называется Ренин-Ангиотензиновой Системой (РАС) или Ренин-Ангиотензин-Альдостероновой Системой (РААС) . Под активацией (усилением активности) РАС подразумевают увеличение уровня в крови Ренина, АТ2.
Высокий уровень Ренина в крови приводит к увеличению уровня АТ2 в крови и тканях. Высокий уровень АТ2 в крови и тканях продолжительное время становится причиной стойкого повышения артериального давления, то есть – .
Уменьшение уровня Ренина в крови взаимосвязано приводит к уменьшению уровня АТ2 в крови и тканях – к уменьшению АД.
Ингибитор Ренина – лекарственное вещество, которое вступает в соединение с Ренином, в результате чего Ренин нейтрализуется, теряет ферментативную активность, уменьшается ферментативная активность Ренина в крови. Ренин связанный с ингибитором Ренина утрачивает способность расщеплять ангиотензиноген до АТ1. При этом взаимосвязано происходит уменьшение уровня АТ2 в крови и тканях – снижение артериального давления, уменьшение активности РАС, улучшение кровотока, кровоснабжения органов и тканей организма.
Алискирен – первый и единственный в настоящее время ингибитор Ренина, с которым проведены все этапы клинических испытаний и который с 2007 года рекомендован для лечения артериальной гипертензии.
Лекарственное вещество Алискирен производится фармацевтической промышленностью под торговыми (коммерческими) названиями:
- Расилез в виде простого лекарственного препарата, который содержит только одно лекарственное вещество – Алискирен;
- Ко-Расилез в виде комбинированного (сложного) лекарственного препарата, который содержит два лекарственных вещества: ингибитор ренина Алискирен и мочегонное лекарственное вещество Гидрохлортиазид (салуретик, тиазидный диуретик).
Ваши отзывы и комментарии о применении ингибитора ренина Алискирена для лечения артериальной гипертензии Вы можете разместить ниже.
Из этой статьи вы узнаете: какие лекарства от гипертонии принадлежат к последнему поколению, и действительно ли они лучше более ранних антигипертензивных средств.
Дата публикации статьи: 14.07.2017
Дата обновления статьи: 02.06.2019
Понятие «последнее поколение» антигипертензивных препаратов не имеет точного определения или годов выпуска. Чаще всего этот термин используют в рекламных целях, продвигая определенный препарат – не обязательно самый эффективный или новый – на фармацевтическом рынке. Но медицинская наука не стоит на месте. Постоянно проводятся испытания новых препаратов от гипертонии, однако их введение в клиническую практику – дело не одного года. Не каждое новое средство демонстрирует более высокую эффективность и безопасность, по сравнению с более старыми, но и лучше испытанными средствами. Практически ежегодно на фармакологический рынок выводятся новые таблетки от гипертонии, содержащие уже давно известные действующие вещества или их комбинацию.
Все же стоить отметить, что у некоторых антигипертензивных препаратов действительно существуют поколения, в таких случаях можно говорить о последней генерации лекарственных средств от высокого давления.
Большинство представителей из списка препаратов от гипертонии нового поколения выпускаются в виде таблеток для перорального применения. Исключением является лабеталол – бета-блокатор, доступный в виде раствора для внутривенного введения. Существуют и другие препараты для парентерального использования (например, нитраты, бензогексоний, нитропруссид натрия), но их трудно отнести к новым лекарственных средствам. Практически всегда внутривенное введение антигипертензивных средств используется для лечения .
В любом случае перед применением новинок в лечении гипертонии необходимо проконсультироваться с кардиологом. Можно также самостоятельно поискать информацию о проведенных научных исследованиях эффективности и безопасности данного препарата по сравнению с уже хорошо изученными средствами.
Ингибиторы ангиотензинпревращающего фермента
Ингибиторы ангиотензинпревращающего фермента (сокращенно иАПФ) – это фармацевтические препараты, которые используются преимущественно для лечения повышенного АД и сердечной недостаточности. Эта группа лекарственных средств подавляет активность ангиотензинпревращающего фермента, который конвертирует неактивный ангиотензин 1 в активный ангиотензин 2, благодаря чему расширяет кровеносные сосуды и снижает нагрузку на сердце.
Первый препарат иАПФ (каптоприл) был открыт более 40 лет назад, с того времени в клиническую практику было внедрено 12 лекарственных средств из этой группы.
В настоящее время чаще всего применяются иАПФ, которые были изобретены еще в 1990-е годы. Их список:
- Рамиприл.
- Периндоприл.
- Зофеноприл.
- Квинаприл.
- Фозиноприл.

Несмотря на достаточно давнее внедрение в клиническую практику, эти препараты продолжают уверенно лидировать среди всех иАПФ, доказав свою высокую эффективность и безопасность во многих исследованиях. Более того, многие научные доказательства говорят о том, что существенных различий в эффективности и безопасности разных представителей иАПФ почти нет. Эффективно снизить АД может как лизиноприл, так и фозиноприл, хотя стоимость этих препаратов в аптеке может различаться в разы.
Кроме лечения артериальной гипертензии, иАПФ применяют при:
- Сердечной недостаточности – эти препараты снижают нагрузку на сердце.
- Диабетической нефропатии – иАПФ помогают поддерживать функциональное состояние почек.
- Хронических заболеваниях почек – иАПФ могут помочь замедлить прогрессирование этих болезней.
- Инфаркте миокарда.

Люди, которым не следует принимать иАПФ:
- Беременные и кормящие грудью женщины.
- Пациенты с повышенной чувствительностью к этим препаратам.
- Пациенты, имеющие определенные заболевания почек – например, стеноз почечной артерии.
Самым частым побочным эффектом всех – даже самых новых – иАПФ является сухой кашель, развивающийся примерно у 10% людей, принимающих эти препараты. Реже встречаются отеки на губах, языке или вокруг глаз, а также ухудшение функций почек.
Блокаторы кальциевых каналов
(сокращенно БКК), иногда называемые антагонистами кальция, – это группа лекарственных средств, которые влияют на попадание ионов кальция внутрь определенных мышечных клеток. Они применяются для лечения различных заболеваний, включая артериальную гипертензию, стенокардию, синдром Рейно и нарушения сердечного ритма, а также для остановки преждевременных родов во время беременности.
Список трех основных групп БКК:
- Группа нифедипина (дигидропиридины).
- Группа дилтиазема (бензотиазепины).
- Группа верапамила (фенилалкиламины).
Для снижения АД чаще всего применяются дигидропиридины, которые были разработаны в 1960-х годах.
Существует 4 поколения препаратов из группы нифедипина:
- 1 поколение – нифедипин;
- 2 поколение – никардипин, фелодипин;
- 3 поколение – амлодипин;
- 4 поколение – цилнидипин.

В клинической практике чаще всего применяются препараты первых трех поколений, цилнидипин врачи назначают достаточно редко.
Амлодипин – пожалуй, самый часто назначаемый препарат из группы БКК. Его начали использовать в 1990 году. Амлодипин продемонстрировал высокую эффективность в лечении артериальной гипертензии, а также и безопасность.
Цилнидипин – это новый препарат 4-го поколения из группы БКК, имеющий определенные преимущества над другими антагонистами кальция. По сравнению с представителями первых трех поколений, которые влияют лишь на L-тип кальциевых каналов, цилнидипин может также блокировать их N-тип. Это свойство может иметь полезное клиническое значение, проявляющееся подавлением рефлекторной тахикардии и уменьшением отеков, которые иногда наблюдаются при применении амлодипина и других, более старых, БКК. Цилнидипин обладает высокой липофильностью, благодаря чему имеет пролонгированное действие. Выпускается цилнидипин под торговыми названиями «Дуокард», «Цилакар», «Ателек».
Противопоказания к назначению дигидропиридинов включают аллергические реакции на конкретный препарат.
| Также антагонисты кальция нужно с осторожностью использовать в следующих ситуациях | Возможные побочные эффекты БКК из группы дигидропиридинов включают |
|---|---|
| Инфаркт миокарда и нестабильная стенокардия | Отеки на ногах |
| Артериальная гипотензия | Усталость |
Аортальный стеноз Нажмите на фото для увеличения Нажмите на фото для увеличения
|
Тошноту |
| Беременность и грудное вскармливание | Головокружение |
| Почечная и печеночная недостаточность | Учащенное сердцебиение |
| Тяжелая сердечная недостаточность | Приливы (ощущение жара, распространяющегося по всему телу, особенно в области лица и шеи) |
Бета-блокаторы
Бета-блокаторы (ББ) – это класс лекарственных средств, которые блокируют рецепторы эндогенных катехоламинов (норадреналин и адреналин), благодаря чему применяются для снижения АД, лечения нарушений сердечного ритма, вторичной миокарда.
Первый ББ (пропранолол) был синтезирован в 1964 году. Многие врачи и ученые сходятся во мнении, что открытие этой группы препаратов является одним из самых важных событий в клинической медицине и фармакологииXX века.
С того времени было разработано достаточно много ББ. Одни из них действуют на все типы бета-адренорецепторов, другие – лишь на один из них. Именно на этих свойствах и выделяют три поколения ББ:
- 1 поколение – пропранолол, тимолол, соталол (неселективные, блокируют бета-1 и бета-2 адренорецепторы)
- 2 поколение – метопролол, бисопролол, эсмолол (селективные, блокируют только бета-1 адренорецепторы)
- 3 поколение – карведилол, небиволол, лабеталол (обладают дополнительными сосудорасширяющими свойствами).

Карведилол – один из ББ третьего поколения, обладающий дополнительным свойством расширения сосудов. Он действует на бета-1- и бета-2-адренорецепторы, а также блокирует альфа-адренорецепторы в сосудах. Благодаря этим эффектам, карведилол сильнее снижает артериальное давление, меньше влияет на частоту сердечных сокращений, не повышает уровни липидов и глюкозы в крови. Недостатком препарата является его действие на бета-2-адренорецепторы, из-за чего повышается риск развития спазма бронхов. Принимать карведилол нужно дважды в день, что не очень удобно для пациента.
Небиволол – препарат, селективно действующий на бета-1-адренорецепторы, который дополнительно обладает сосудорасширяющими свойствами благодаря усилению синтеза оксида азота (NO) в эндотелии сосудов. Благодаря этим эффектам, небиволол лучше снижает артериальное давление, меньше влияет на частоту сердечных сокращений, не повышает уровни липидов и глюкозы в крови, не вызывает эректильной дисфункции. Негативным свойством этого препарата является довольно слабое действие на бета-блокаторы, поэтому его чаще всего применяют у пожилых людей с сердечной недостаточностью.

Лабеталол – препарат, обладающий неселективными бета-блокирующими свойствами и влиянием на альфа-рецепторы. Лабеталол используется преимущественно в виде внутривенного введения, при котором он имеет очень короткое время действия, что позволяет добиться хорошего контроля над эффектами препарата. Это наиболее эффективный бета-блокатор для лечения гипертонических кризов. Его часто применяют при феохромоцитоме (опухоль надпочечников) и преэклампсии (поздний токсикоз у беременных).
Список общих для бета-блокаторов побочных эффектов:
Блокаторы рецепторов ангиотензина 2
Блокаторы рецепторов ангиотензина 2 (БРА), или сартаны – самая новая группа лекарственных средств, широко применяемых для лечения артериальной гипертензии. Первый сартан (лозартан) был внедрен в практику в 1986 году.
Действие сартанов основано на блокаде последнего уровня ренин-ангиотензиновой системы, то есть на предотвращении связывания ангиотензина 2 с его рецепторами. Благодаря этим эффектам, БРА вызывают расширение сосудов, сокращают секрецию вазопрессина и альдостерона (гормоны, способствующие задержке жидкости и натрия в организме), что приводит к снижению артериального давления.
Самыми последними БРА, допущенными к клиническому применению, являются олмесартан (Кардосал), фимасартан (Канарб) и азилсартан (Эдарби).

Показания к применению сартанов, включая самые новые препараты:
- Артериальная гипертензия.
- Сердечная недостаточность.
- Патология почек при сахарном диабете.
- Хронические заболевания почек.
Как видно, показания к применению сартанов практически те же, что и для использования другой группы препаратов, влияющих на ренин-ангиотензиновую систему – иАПФ. В большинстве случаев БРА назначают в тех ситуациях, когда прием иАПФ привел к появлению побочного действия (сухого кашля). Следует учитывать, что более старые иАПФ обладают практически такой же эффективностью в снижении артериального давления, стоят меньше и имеют определенные преимущества над сартанами при лечении пациентов с сахарным диабетом.
Прием сартанов обычно хорошо переносится большинством пациентов.
Прямые ингибиторы ренина (алискирен)
Алискирен – лекарство от гипертонии нового поколения, которое еще не приобрело большой распространенности. Единственным препаратом этого класса является алискирен, который получил разрешение для клинического использования в 2007 году.

Алискирен связывается с ренином, подавляя его взаимодействие с ангиотензиногеном, благодаря чему предотвращается образование ангиотензина 1и ангиотензина 2.
Алискирен применяется лишь для лечения артериальной гипертензии, да и при этом заболевании его не рекомендуют использовать в качестве первой линии терапии.
Ренин-ангиотензин-альдостероновая система (РААС ) регулирует АД, а также натриевый и водный гомеостаз.
Ренин синтезируется специализированными гладкомышечными клетками в стенке приносящей артериолы почечного клубочка (юкстагломерулярный аппарат). Выброс ренина может быть обусловлен падением почечного перфузионного давления и симпатической активацией p-адренорецепторов в юкстагломерулярных клетках.
Как только ренин попадает в кровь, он расщепляет синтезируемый в печени ангиотензиноген до декапептида ангиотензина I. АПФ, в свою очередь, превращает ангиотензин II в биологически активный ангиотензин II.
АПФ , циркулирующий в плазме, локализуется на поверхности эндотелиальных клеток. Это неспецифическая пептидаза, способная отщеплять С-терминальные дипептиды от разнообразных пептидов (дипептидилкарбоксипептидаза). Таким образом, АПФ помогает инактивировать кинины, например брадикинин.
Ангиотензин II
может активировать два разных рецептора (АТ 1 и АТ 2), связанных с G-белками. Наиболее значимое действие, которое ангиотензин II оказывает на сердечно-сосудистую систему, опосредовано АТ 1 -рецепторами. Ангиотензин II повышает АД различными способами:
1) сужением сосудов как артериального, так и венозного русла;
2) стимуляцией секреции альдостерона, приводящей к увеличению почечной реабсорбции NaCl и воды, а следовательно, и к увеличению ОЦК;
3) центральным повышением тонуса симпатической нервной системы, а на периферии - усиленным выделением и действием норадреналина. Длительное повышение уровня ангиотензина II может привести к гипертрофии мышечных клеток сердца и артерий и увеличению количества соединительной ткани (фиброз).
а) Ингибиторы АПФ , такие как каптоприл и эналаприл, занимают активный центр этого фермента, конкурентно ингибируя расщепление ангиотензина I. Эти препараты применяются при гипертензии и хронической сердечной недостаточности. Снижение повышенного АД обусловлено главным образом уменьшением образования ангиотензина II. Также свой вклад может вносить ослабление распада кининов, оказывающих сосудорасширяющее действие.
При застойной сердечной недостаточности после применения повышается минутный объем сердца, т. к. вследствие падения периферического сопротивления уменьшается постнагрузка желудочков. Уменьшается венозный застой (предна-грузка), снижается секреция альдостерона и тонус венозных емкостных сосудов.
Побочные эффекты . Если активация РААС обусловлена потерей электролитов и воды (в результате лечения мочегонными препаратами, сердечной недостаточности или стеноза почечной артерии), применение ингибиторов АПФ вначале может вызывать чрезмерное падение АД. Достаточно часто наблюдается такой побочный эффект, как сухой кашель (10%), причиной которого может быть снижение инактивации кининов в слизистой оболочке бронхов.
Комбинация ингибиторов АПФ с калийсберегающими диуретиками может приводить к гиперкалиемии. В большинстве случаев ингибиторы АПФ хорошо переносятся и дают хороший терапевтический эффект.
К новым аналогам данных препаратов относятся лизиноприл, рамиприл.квинаприл, фозиноприл и беназеприл.
б) Антагонисты АТ 1 -рецепторов ангиотензина II («сартаны »). Блокада АТ 1 -рецепторов антагонистами подавляет активность ангиотензина II. Первым препаратом в группе «сартанов» был лозартан, вскоре были разработаны аналоги. К ним относятся кандесартан, эпросартан, олменсартан, телмесартан и валсартан. Основные (гипотензивные) эффекты и побочное действие такие же, как у ингибиторов АПФ. Однако «сартаны» не вызывают сухой кашель, т. к. не ингибируют распад кининов.
в) Ингибитор ренина . С 2007 г. на рынке появился прямой ингибитор ренина (алискирен), который можно использовать для лечения гипертензии. Этот препарат плохо всасывается после приема внутрь (биодоступность 3%) и очень медленно выводится (период полураспада 40 ч). Спектр его действия аналогичен антагонистам АТ 1 -рецепторов.
Для цитирования:
Леонова М.В. Новые и перспективные лекарственные препараты, блокирующие ренин-ангиотензин-альдостероновую систему // РМЖ. Медицинское обозрение. 2013. №17. С. 886
Роль ренин-ангиотензин-альдостероновой системы (РААС) в развитии артериальной гипертонии (АГ) и других сердечно-сосудистых заболеваний в настоящее время считается главенствующей. В кардиоваскулярном континууме АГ находится среди факторов риска, а главным патофизиологическим механизмом поражения сердечно-сосудистой системы является ангиотензин II (АТII). АТII является ключевым компонентом РААС - эффектором, который реализует вазоконстрикцию, задержку натрия, активацию симпатической нервной системы, клеточную пролиферацию и гипертрофию, развитие оксидативного стресса и процессов воспаления сосудистой стенки.
В настоящее время уже получили развитие и широкое клиническое применение два класса препаратов, блокирующих РААС, - ингибиторы АПФ и блокаторы рецепторов АТII. Фармакологические и клинические эффекты этих классов имеют отличия. АПФ является пептидазой из группы цинк-металлопротеиназ, которая метаболизирует АТI, АТ1-7, брадикинин, субстанцию Р и многие другие пептиды . Механизм действия ингибиторов АПФ главным образом связан с предотвращением образования АТII, что способствует вазодилатации, натрийурезу и устраняет провоспалительный, пролиферативный и другие эффекты АТII. Кроме того, ингибиторы АПФ препятствуют деградации брадикинина и повышают его уровень. Брадикинин - мощный вазодилататор, он потенцирует натрийурез, а главное - обладает кардиопротективным (предотвращает гипертрофию, уменьшает ишемическое повреждение миокарда, улучшает коронарное кровоснабжение) и вазопротективным действием, улучшая эндотелиальную функцию. Вместе с тем, высокий уровень брадикинина - причина развития ангионевротического отека, что является одним из серьезных недостатков ингибиторов АПФ, которые значительно повышают уровень кининов.
Ингибиторам АПФ не всегда удается полностью блокировать образование АТII в тканях. В настоящее время установлено, что в его превращении в тканях могут участвовать и другие ферменты, не связанные с АПФ, прежде всего эндопептидазы, на которые действие ингибиторов АПФ не распространяется. В результате ингибиторы АПФ не могут полностью устранить эффекты АТII, что может быть причиной их недостаточной эффективности.
Решению этой проблемы способствовало открытие рецепторов АТII и первого класса препаратов, селективно блокирующих АТ1-рецепторы. Через АТ1-рецепторы реализуются неблагоприятные эффекты АТII: вазоконстрикция, секреция альдостерона, вазопрессина, норадреналина, задержка жидкости, пролиферация гладкомышечных клеток и кардиомиоцитов, активация САС, а также механизм отрицательной «обратной связи» - образование ренина. АТ2-рецепторы выполняют «полезные» функции, такие как вазодилатация, процессы репарации и регенерации, антипролиферативное действие, дифференцировка и развитие эмбриональных тканей. Клинические эффекты блокаторов рецепторов АТII опосредованы через устранение «вредных» эффектов АТII на уровне АТ1-рецепторов, что обеспечивает более полное блокирование неблагоприятных эффектов АТII и усиление влияния АТII на АТ2-рецепторы, что дополняет вазодилатирующий и антипролиферативный эффекты. Блокаторы рецепторов АТII обладают специфичным действием на РААС, не вмешиваясь в кининовую систему. Отсутствие влияния на активность кининовой системы, с одной стороны, уменьшает выраженность нежелательных эффектов (кашель, ангионевротический отек), но, с другой, лишает блокаторы рецепторов АТII важного антиишемического и вазопротективного действия, что отличает их от ингибиторов АПФ. По этой причине показания к применению блокаторов рецепторов АТII в большинстве повторяют показания к назначению ингибиторов АПФ, делают их альтернативными препаратами.
Несмотря на внедрение блокаторов РААС в широкую практику лечения АГ, проблемы улучшения исходов и прогноза остаются. К ним относятся: возможность улучшения контроля АД в популяции, эффективность лечения резистентной АГ, возможности дальнейшего снижения риска сердечно-сосудистых заболеваний.
Поиск новых путей воздействия на РААС активно продолжается; изучаются другие тесно взаимодействующие системы и создаются препараты с множественным механизмом действия, такие как ингибиторы АПФ и нейтральной эндопептидазы (НЭП), ингибиторы эндотелин-превращающего фермента (ЭПФ) и НЭП, ингибиторы АПФ/НЭП/ЭПФ .
Ингибиторы вазопептидаз
К вазопептидазам кроме известного АПФ относятся еще 2 других цинк-металлопротеиназы - неприлизин (нейтральная эндопептидаза, НЭП) и эндотелин-превращающий фермент, которые также могут быть мишенями для фармакологического воздействия.
Неприлизин - фермент, вырабатываемый эндотелием сосудов и участвующий в деградации натрийуретического пептида, а также брадикинина.
Система натрийуретического пептида представлена тремя разными изоформами: предсердным натрий-уретическим пептидом (А-тип), мозговым натрийуретическим пептидом (В-тип), которые синтезируются в предсердии и миокарде, и эндотелиальным С-пептидом, которые по своим биологическим функциям являются эндогенными ингибиторами РААС и эндотелина-1 (табл. 1) . Кардиоваскулярные и ренальные эффекты натрийуретического пептида заключаются в снижении АД через влияние на сосудистый тонус и водноэлектролитный баланс, а также в антипролиферативном и антифибротическом действии на органы-мишени. По самым последним данным, система натрийуретического пептида участвует в метаболической регуляции: окислении липидов, образовании и дифференцировке адипоцитов, активации адипонектина, секреции инсулина и толерантности к углеводам, что может обеспечивать защиту от развития метаболического синдрома .
К настоящему времени стало известно, что развитие сердечно-сосудистых заболеваний ассоциируется с дизрегуляцией системы натрийуретического пептида. Так, при АГ наблюдается дефицит натрийуретического пептида, приводящий к солечувствительности и нарушению натрийуреза; при хронической сердечной недостаточности (ХСН) на фоне дефицита наблюдается аномалия функционирования гормонов системы натрийуретического пептида .
Поэтому для потенцирования системы натрийуретического пептида с целью достижения дополнительного гипотензивного и протективных кардиоренальных эффектов возможно применение ингибиторов НЭП. Ингибирование неприлизина приводит к потенцированию натрийуретического, диуретического и вазодилатирующего эффектов эндогенного натрийуретического пептида и в результате - к снижению АД. Однако НЭП участвует в деградации и других вазоактивных пептидов, в частности АТI, АТII и эндотелина-1. Поэтому баланс эффектов воздействия на сосудистый тонус ингибиторов НЭП вариабельный и зависит от преобладания констрикторных и дилатирующих влияний. При длительном применении антигипертензивное действие ингибиторов неприлизина выражено слабо вследствие компенсаторной активации образования АТII и эндотелина-1 .
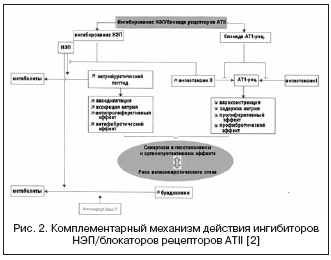
В этой связи сочетание эффектов ингибиторов АПФ и ингибиторов НЭП может существенно потенцировать гемодинамические и антипролиферативные эффекты в результате комплементарного механизма действия, что привело к созданию препаратов с двойным механизмом действия, объединенных названием - ингибиторы вазопептидаз (табл. 2, рис. 1) .
Известные ингибиторы вазопептидаз характеризуются разной степенью селективности к НЭП/АПФ: омапатрилат - 8,9:0,5; фазидоприлат - 5,1:9,8; сампатрилат - 8,0:1,2 . В результате ингибиторы вазопептидаз получили гораздо большие возможности в достижении гипотензивного эффекта вне зависимости от активности РААС и уровня задержки натрия и в органопротекции (регресс гипертрофии, альбуминурии, жесткости сосудов). Наиболее изученным в клинических исследованиях был омапатрилат, который показал более высокую гипотензивную эффективность в сравнении с ингибиторами АПФ, а у пациентов с ХСН приводил к увеличению фракции выброса и улучшению клинических исходов (исследования IMPRESS, OVERTURE), но без преимуществ перед ингибиторами АПФ .
Однако в крупных клинических исследованиях с применением омапатрилата была установлена более высокая частота развития ангионевротического отека в сравнении с ингибиторами АПФ. Известно, что частота развития ангионевротического отека при использовании ингибиторов АПФ составляет от 0,1 до 0,5% в популяции, из них 20% случаев являются жизнеугрожающими, что связано с многократным повышением концентраций брадикинина и его метаболитов . Результаты крупного многоцентрового исследования OCTAVE (n=25 302), которое было специально спланировано для изучения частоты развития ангионевротического отека, показало, что частота развития этого побочного эффекта на фоне лечения омапатрилатом превышает таковую в группе эналаприла - 2,17% против 0,68% (относительный риск 3,4) . Это объяснялось усилением влияния на уровень кининов при синергичном ингибировании АПФ и НЭП, связанным с ингибированием аминопептидазы Р, участвующей в деградации брадикинина .
Новый двойной ингибитор вазопептидаз, блокирующий АПФ/НЭП, - илепатрил, который имеет более высокую аффинность к АПФ в сравнении с НЭП . При изучении фармакодинамических эффектов илепатрила по влиянию на активность РААС и натрийуретического пептида у здоровых добровольцев было установлено, что препарат дозозависимо (в дозах 5 и 25 мг) и значимо (более 88%) подавляет АПФ в плазме крови продолжительностью более 48 ч вне зависимости от солечувствительности. Одновременно препарат значимо повышал активность ренина плазмы в течение 48 ч и уменьшал уровень альдостерона . Эти результаты показали выраженное и более продолжительное подавление РААС в отличие от ингибитора АПФ рамиприла в дозе 10 мг, что объяснялось более значимым тканевым действием илепатрила на АПФ и большей аффинностью к АПФ, и сопоставимую степень блокады РААС в сравнении с комбинацией 150 мг ирбесартана + 10 мг рамиприла. В отличие от действия на РААС, эффект илепатрила на натрийуретический пептид проявлялся кратковременным увеличением уровня его экскреции в период 4-8 ч после приема дозы 25 мг, что свидетельствует о меньшей и слабой аффинности к НЭП и отличает его от омапатрилата. Причем по уровню экскреции электролитов дополнительного натрийуретического действия в сравнении с рамиприлом или ирбесартаном у препарата нет, как впрочем, и у других ингибиторов вазопептидаз. Максимальное гипотензивное действие развивается через 6-12 ч после приема препарата, и снижение среднего АД составляет 5±5 и 10±4 мм рт.ст. при низкой и высокой солечувствительности соответственно . По фармакокинетическим характеристикам илепатрил представляет собой пролекарство с активным метаболитом, который быстро образуется с достижением максимальной концентрации через 1-1,5 ч и медленно элиминирует. В настоящее время проводятся клинические исследования III фазы.
Альтернативный путь к двойному подавлению РААС и НЭП представлен сочетанием блокады рецепторов АТII и НЭП (рис. 2) . Блокаторы рецепторов АТII не влияют на метаболизм кининов в отличие от ингибиторов АПФ, поэтому потенциально имеют меньший риск развития ангионевротических осложнений. В настоящее время проходит фазу III клинических исследований первый препарат - блокатор рецепторов АТII с эффектом ингибирования НЭП в соотношении 1:1 - LCZ696. Объединенная молекула препарата содержит валсартан и ингибитор НЭП (AHU377) в форме пролекарства . В крупном исследовании у больных с АГ (n=1328) препарат LCZ696 в дозах 200-400 мг показал преимущество в гипотензивном эффекте перед валсартаном в дозах 160-320 мг в виде дополнительного снижения АД на 5/3 и 6/3 мм рт.ст. . Гипотензивный эффект LCZ696 сопровождался более выраженным снижением пульсового АД: на 2,25 и 3,32 мм рт.ст. соответственно в дозах 200 и 400 мг, что в настоящее время рассматривается как положительный прогностический фактор по влиянию на жесткость сосудистой стенки и сердечно-сосудистые исходы. При этом изучение нейрогуморальных биомаркеров на фоне лечения LCZ696 показало увеличение уровня натрийуретического пептида при сопоставимой степени увеличения уровня ренина и альдостерона в сравнении с валсартаном. Переносимость у больных с АГ была хорошей, и случаев ангионевротического отека не было отмечено. В настоящее время завершено исследование PARAMOUMT у 685 пациентов с ХСН и ненарушенной ФВ . Результаты исследования показали, что LCZ696 быстрее и выраженнее снижает уровень NT-proBNP (первичная конечная точка - маркер повышения активности натрий-уретического пептида и неблагоприятного прогноза при ХСН) в сравнении с валсартаном, а также уменьшает размеры левого предсердия, что свидетельствует о регрессе его ремоделирования . Исследование у пациентов с ХСН и сниженной ФВ продолжается в настоящее время (исследование PARADIGM-HF).
Ингибиторы системы эндотелина
Система эндотелина играет важную роль в регуляции сосудистого тонуса и регионального кровотока. Среди трех известных изоформ эндотелин-1 является наиболее активным. Кроме известных вазоконстрикторных эффектов эндотелин стимулирует пролиферацию и синтез межклеточного матрикса, а также вследствие прямого воздействия на тонус почечных сосудов участвует в регуляции водно-электролитного гомеостаза. Эффекты эндотелина реализуются через взаимодействие со специфическими рецепторами А-типа и В-типа, функции которых взаимопротивоположны: через А-тип рецепторов происходит вазоконстрикция, а через В-тип - вазодилатация . В последние годы установлено, что рецепторы В-типа играют большую роль в клиренсе эндотелина-1, т.е. при блокаде этих рецепторов нарушается рецепторзависимый клиренс эндотелина-1 и увеличивается его концентрация . Кроме того, рецепторы В-типа участвуют в регуляции почечных эффектов эндотелина-1 и поддержании водно-электролитного гомеостаза, что имеет важное значение.
В настоящее время роль эндотелина доказана в развитии ряда заболеваний, в т.ч. АГ, ХСН, легочной гипертензии, хронических заболеваний почек; показана тесная связь между уровнем эндотелина и метаболическим синдромом, дисфункцией эндотелия и атерогенезом. С 1990-х гг. ведется поиск антагонистов рецепторов эндотелина, пригодных для клинического использования; уже известно 10 препаратов («сентаны») с разной степенью селективности к А/B-типу рецепторов . Первый неселективный антагонист рецепторов эндотелина - бозентан - в клиническом исследовании у больных с АГ показал гипотензивную эффективность, сопоставимую с таковой ингибитора АПФ эналаприла . Дальнейшие исследования эффективности применения антагонистов эндотелина при АГ показали их клиническую значимость в лечении резистентной АГ и при высоком сердечно-сосудистом риске. Эти данные были получены в двух крупных клинических исследованиях DORADO (n=379) и DORADO-АС (n=849), в которых пациентам с резистентной АГ добавлялся дарусентан к тройной комбинированной терапии . В исследовании DORADO у пациентов резистентная АГ сочеталась с хронической болезнью почек и протеинурией, в результате добавления дарусентана наблюдалось не только значительное снижение АД, но и уменьшение экскреции белка. Антипротеинурический эффект антагонистов рецепторов эндотелина был в последующем подтвержден в исследовании у пациентов с диабетической нефропатией при использовании авосентана . Однако в исследовании DORADO-АС преимуществ в дополнительном снижении АД перед препаратами сравнения и плацебо не было выявлено, что послужило поводом к прекращению дальнейших исследований. Кроме того, в 4 крупных исследованиях антагонистов эндотелина (бозентана, дарусентана, энрасентана) у пациентов с ХСН были получены противоречивые результаты, что объяснялось увеличением концентрации эндотелина-1 . Дальнейшее изучение антагонистов рецепторов эндотелина было приостановлено ввиду нежелательных эффектов, связанных с задержкой жидкости (периферические отеки, перегрузка объемом). Развитие этих эффектов связывают с воздействием антагонистов эндотелина на В-тип рецепторов, что изменило поиск препаратов, влияющих на систему эндотелина через другие пути; а антагонисты рецепторов эндотелина в настоящее время имеют только одно показание - лечение легочной гипертензии.
С учетом высокой значимости системы эндотелина в регуляции сосудистого тонуса ведется поиск другого механизма воздействия через вазопептидазу - ЭПФ, участвующий в образовании активного эндотелина-1 (рис. 3) . Блокирование ЭПФ и сочетание с ингибированием НЭП позволяют эффективно подавлять образование эндотелина-1 и потенцировать эффекты натрий-уретического пептида. Преимущества двойного механизма действия заключаются, с одной стороны, в предупреждении недостатков ингибиторов НЭП, связанных с возможной вазоконстрикцией, опосредованной активацией эндотелина, с другой, натрийуретическая активность ингибиторов НЭП позволяет компенсировать задержку жидкости, связанную с неселективной блокадой эндотелиновых рецепторов. Даглутрил является двойным ингибитором НЭП и ЭПФ, который находится во II фазе клинических исследований . В исследованиях показаны выраженные кардиопротективные эффекты препарата благодаря уменьшению ремоделирования сердца и сосудов, регрессу гипертрофии и фиброза.
Прямые ингибиторы ренина
Известно, что ингибиторы АПФ и блокаторы рецепторов АТII по механизму обратной связи повышают активность ренина, что является причиной ускользания эффективности блокаторов РААС. Ренин представляет собой самый первый этап каскада РААС; он вырабатывается юкстагломерулярными клетками почек. Ренин через ангиотензиноген способствует образованию АТII, вазоконстрикции и секреции альдостерона, а также регулирует механизмы обратной связи. Поэтому ингибирование ренина позволяет достичь более полной блокады системы РААС. Поиск ингибиторов ренина ведется с 1970-х гг.; долгое время не удавалось получить пер-оральную форму ингибиторов ренина ввиду их низкой биодоступности в ЖКТ (менее 2%). Первый прямой ингибитор ренина, пригодный для перорального применения, - алискирен - был зарегистрирован в 2007 г. Алискирен имеет низкую биодоступность (2,6%), большой период полувыведения (24-40 ч), внепочечный путь элиминации . Фармакодинамика алискирена связана с 80% уменьшением уровня АТII. В клинических исследованиях у пациентов с АГ алискирен в дозах 150-300 мг/сут приводил к снижению САД на 8,7-13 и 14,1-15,8 мм рт.ст. соответственно и ДАД - на 7,8-10,3 и 10,3-12,3 мм рт.ст. . Гипотензивный эффект алискирена наблюдался в разных подгруппах пациентов, включая больных с метаболическим синдромом, ожирением; по выраженности он был сопоставим с эффектом ингибиторов АПФ, блокаторов рецепторов АТII, а также отмечен аддитивный эффект в комбинации с валсартаном, гидрохлоротиазидом и амлодипином. В ряде клинических исследований были показаны органопротективные эффекты препарата: антипротеинурический эффект у пациентов с диабетической нефропатией (исследование AVOID, n=599) , регресс гипертрофии левого желудочка у пациентов с АГ (исследование ALLAY, n=465) . Так, в исследовании AVOID после 3-месячного лечения лозартаном в дозе 100 мг/сут и достижения целевого уровня АД (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Кроме того, проводится серия клинических исследований алискирена при лечении других сердечно-сосудистых заболеваний с оценкой влияния на прогноз больных: исследования ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n=7000) у пациентов с ХСН, исследование ALTITUDE у пациентов с сахарным диабетом и высоким сердечно-сосудистым риском, исследование ASPIRE у пациентов с постинфарктным ремоделированием.
Заключение
Для решения проблем предупреждения сердечно-сосудистых заболеваний продолжается создание новых лекарственных препаратов со сложным множественным механизмом действия, позволяющих обеспечивать более полную блокаду РААС через каскад механизмов гемодинамической и нейрогуморальной регуляции. Потенциальные эффекты таких препаратов позволяют не только обеспечивать дополнительный гипотензивный эффект, но и достигать контроля уровня АД у пациентов высокого риска, включая резистентную форму АГ. Лекарственные препараты с множественным механизмом действия демонстрируют преимущества в более выраженном органопротективном действии, что позволит предупреждать дальнейшее поражение сердечно-сосудистой системы. Изучение преимуществ новых препаратов, блокирующих РААС, требует дальнейших исследований и оценки их влияния на прогноз больных с АГ и другими сердечно-сосудистыми заболеваниями.



Литература
1. Campbell D.J. Vasopeptidase inhibition: a doubleedged sword? // Hypertension. 2003. Vol. 41. P. 383-389.
2. Laurent S., Schlaich M., Esler M. New drugs, procedures, and devices for hypertension // Lancet. 2012. Vol. 380. P. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. et al. Vasopeptidase inhibitors: a new therapeutic concept in cardiovascular disease? // Circulation. 2001. Vol. 104. P. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. Neutral endopeptidase inhibition and the natriuretic peptide system: an evolving strategy in cardiovascular therapeutics // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et al. Comparison of vasopeptidase inhibitor, omapatrilat, and lisinopril on exercise tolerance and morbidity in patients with heart failure: IMPRESS randomised trial // Lancet. 2000. Vol. 356. P. 615-620.
6. Packer M., Califf R.M., Konstam M.A. et al. Comparison of omapatrilat and enalapril in patients with chronic heart failure: The Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002. Vol. 106. P. 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Angiotensin II receptor blockers in patients with ACE inhibitor-induced angioedema // Ann. Pharmacother. 2000. Vol. 34. P. 526-528.
8. Kostis J.B., Packer M., Black H.R. et al. Omapatrilat and enalapril in patients with hypertension:the Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) trial // Am. J. Hypertens. 2004. Vol. 17. P. 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. Pharmacokinetics and pharmacodynamics of the vasopeptidase inhibitor AVE7688 in humans // Clin. Pharmacol. Ther. 2006. Vol. 79. P. 49-61.
10. Gu J., Noe A., Chandra P. et al. Pharmacokinetics and pharmacodynamics of LCZ696, a novel dualacting angiotensin receptorneprilysin inhibitor (ARNi) // J. Clin. Pharmacol. 2010. Vol. 50. P. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. Bloodpressure reduction with LCZ696, a novel dualacting inhibitor of the angiotensin II receptor and neprilysin: a randomised, double-blind, placebo-controlled, active comparator study // Lancet. 2010. Vol. 375. P. 1255-1266.
12. Solomon S.D., Zile M., Pieske B. et al. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial // Lancet. 2012. Vol. 380(9851). P. 1387-1395.
13. Levin E.R. Endothelins // N. Engl. J. Med. 1995. Vol. 333. P. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. et al. Role of endothelin-1 in clinical hypertension: 20 years on // Hypertension. 2008. Vol. 52. P. 452-459.
15. Burnier M., Forni V. Endothelin receptor antagonists: a place in the management of essential hypertension? // Nephrol. Dial. Transplant. 2011. 0: 1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. et al. The effect of an endothelin-receptor antagonist, bosentan, on blood pressure in patients with essential hypertension. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998. Vol. 338. P. 784-790.
17. Weber M.A., Black H., Bakris G. et al. A selective endothelin-receptor antagonist to reduce blood pressure in patients with treatment-resistant hypertension: a randomised, double-blind, placebo-controlled trial // Lancet. 2009. Vol. 374. P. 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et al. Divergent results using clinic and ambulatory blood pressures: report of a darusentan-resistant hypertension trial // Hypertension. 2010. Vol. 56. P. 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentan for overt diabetic nephropathy // J. Am. Soc. Nephrol. 2010. Vol. 21. P. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et al. Endothelinconverting enzyme/neutral endopeptidase inhibitor SLV338 prevents hypertensive cardiac remodeling in a blood pressure-independent manner // Hypertension. 2011. Vol. 57. P. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. Angiotensin II suppression in humans by theorally active renin inhibitor Aliskiren (SPP100): comparison with enalapril // Hypertension. 2002. Vol. 39(1). P. E1-8.
22. Alreja G., Joseph J. Renin and cardiovascular disease: Wornout path, or new direction? // World J. Cardiol. 2011. Vol. 3(3). P. 72-83.
23. Ingelfinger J.R. Aliskiren and dual therapy in type 2 diabetes mellitus // N. Engl. J. Med. 2008. Vol. 358(23). P. 2503-2505.
24. Pouleur A.С., Uno H., Prescott M.F., Desai A. (for the ALLAY Investigators). Suppression of aldosterone mediates regression of left ventricular hypertrophy in patients with hypertension // J. Renin-Angiotensin-Aldosterone System. 2011. Vol. 12. P. 483-490.
25. Kelly D.J., Zhang Y., Moe G. et al. Aliskiren, a novel renin inhibitor, is renoprotective in a model of advanced diabetic nephropathy in rats // Diabetol. 2007. Vol. 50. P. 2398-2404.
История изучения ренин-ангиотензинальдостероновой системы (РААС), оказавшаяся наиболее успешной с точки зрения разработки подходов к фармакологической модуляции ее активности, позволяющих продлить жизнь пациентов с сердечно-сосудистыми и почечными заболеваниями, началась 110 лет назад. Когда был идентифицирован ренин – первый компонент. В дальнейшем в экспериментальных и клинических исследованиях удалось уточнить физиологическую роль ренина и его значение в регуляции активности РААС при разных патологических состояниях, ставшие основой для разработки высокоэффективной терапевтической стратегии – прямых ингибиторов ренина.
В настоящее время первый прямой ингибитор ренина Расилез (алискирен) назначение обосновано даже в тех ситуациях, когда другие блокаторы РААС – иАПФ и БРА не показаны или применение их затруднено в связи с развитием нежелательных явлений.
Еще одним обстоятельством, позволяющим рассчитывать на дополнительные по сравнению с другими блокаторами РААС возможности прямых ингибиторов ренина в защите органов-мишеней АГ, является то, что при применении препаратов, блокирующих РААС на других уровнях, по закону отрицательной обратной связи происходит как увеличение концентрации проренина, так и увеличение плазменной активности ренина. Именно этим обстоятельством отменяется нередко отмечаемое снижение эффективности иАПФ, в том числе и с точки зрения их возможностей в снижении повышенной АД. Еще в начале 1990-х годов, когда многие органопротективные эффекты иАПФ не были установлены так достоверно, как сегодня, было показано, что по мере увеличения их дозы достоверно нарастают плазменная активность ренина и плазменная концентрация ангиотензина. Наряду с иаПФ и БРА, провоцировать подъем плазменной активности ренина могут также тиазидовые и петлевые диуретики.
Первым прямым ингибитором ренина, эффективность которого была подтверждена в контролируемых клинических исследованиях III фазы, обладающим достаточной продолжительностью действия и снижающим повышенное АД даже в режиме монотерапии, стал алискирен, и его назначение сегодня можно рассматривать как инновационный подход к лечению АГ. Были проведены сопоставления его влияния на плазменную концентрацию и активность отдельных составляющих РААС с иАПФ и БРА. Оказалось, что алискирен и эналаприл почти в равной степени уменьшают плазменную концентрацию ангиотензина II, но в отличие от алискирена прием эналаприла приводил к более чем 15-кратному росту активности ренина в плазме крови. Способность алискирена предупреждать негативные изменения в балансе активности компонентов РААС была также продемонстрирована при его сопоставлении с БРА.
Объединенный анализ клинических исследования, суммарно включавших 8481 больного, получавших монотерапию алискиреном или плацебо, показал, что однократный прием алискирена в дозе 150 мг/сут. или 300 мг/сут. обуславливал снижение САД на 12,5 и 15,2 мм рт.ст. соответственно в сравнении со снижением на 5,9 мм рт.ст., плацебо (Р<0,0001). Диастолическое АД снижалось на 10,1 и 11,8 мм рт.ст. соответственно (в группе, принимавшей плацебо – на 6,2 мм рт.ст.; Р < 0,0001). Различий в антигипертензивном эффекте алискирена у мужчин и женщин, а также у лиц старше и моложе 65 лет не выявлено.
В 2009 году опубликованы результаты многоцентрового контролируемого клинического исследования, в котором у 1124 больных АГ сравнивали эффективность алискирена и гидрохлортиазида. При необходимости к этим препаратам присоединяли амлодипин. Уже к завершению периода монотерапии стало ясным, что алискирен приводит к более выраженному снижению АД, чем гидрохлортиазиду (-17,4/-12,2 мм рт.ст. против -14,7/-10,3 мм рт.ст.; Р < 0,001)




