Физические свойства титана. Мировой рынок титана. Восстановление четыреххлористого титана магнием
Титан особо ценится за низкую плотность в сочетании с высокой прочностью и отличной стойкостью к коррозии. Максимальный показатель прочности на разрыв чистого титана может достигнуть 740 Н/мм2, а показатель такого сплава как LT 33, содержащего алюминий, ванадий и олово, достигает 1200 Н/мм2. Температурный коэффициент расширения металла составляет около половины от температурного коэффициента расширения нержавеющей стали и меди, и одну третью часть от данного коэффициента алюминия. Его плотность составляет около 60% от плотности стали, одну вторую от плотности меди и в 1.7 раз больше, чем у алюминия. Его модуль упругости составляет половину от модуля упругости нержавеющей стали, что делает его стойким и прочным к ударам.Авиакосмическая промышленность остается самым крупным потребителем этого металла. Титановые сплавы, способные к функционированию при температурах от 0°С до 600°С, используются в авиадвигателях для дисков, лопастей, валов и корпусов. Высокопрочные сплавы широко используются в производстве различных деталей, входящих в конструкцию летательных аппаратов - от мелких крепежных деталей, которые весят несколько граммов, до тележек шасси и больших крыльевых балок, вес которых достигает 1 тонны. Титан может составлять 10 процентов ненагруженного веса некоторых серийных пассажирских самолетов. Сейчас титан в основном потребляется в виде диоксида титана - нетоксичного белого пигмента, который используют для производства красок, бумаги, пластмассы и косметики.
Вопросы для самопроверки
Почему еще кто-то хочет, чтобы титановый лом был менее ясным. Полагаю, приятно, что он никогда не ржавеет, но У меня не было этой проблемы с моей половиной дюжины других ломов. Интересно, как их можно сделать так дешево, учитывая, как дорого стоят другие вещи из титана. за последние несколько лет цена на титан резко снизилась из-за открытия поставок из бывшего Советского Союза и разработки нового, более дешевого процесса его переработки. Не только это, увидев выше, читатель Майкл Шульц написал, чтобы сообщить мне, что для титановых ломов хорошо используется.
Начало
Хотя о существовании титановых минералов известно более 200 лет, серийное производство титана и пигмента диоксида титана для продажи началось не раньше 1940 года. В.Дж.Кроли запатентовал метод производства титана методом угле-хлорирования титанового диоксида в 1938году. Этот элемент был назван в честь Титанов из греческой мифологии немецким химиком МТ.Клапрот, который успешно отделил диоксид титана от рутила в конце восемнадцатого века.
Рассказ: дайверы, нуждающиеся в ломте под водой, будут более безопасными и более удобными с титановым лом. Длинная история: вес регулярного лома может привести к тому, что дайвер будет иметь избыточный вес во время дайвинга или потребует, чтобы дайвер изнашивал меньше веса в своем кармане для поддержания плавучести. Часть дайвинга - это вечная борьба за плавучесть. Из-за этого дайверы должны иметь определенное количество свинцовых весов, прикрепленных к ним, чтобы помочь им оставаться погруженными.
Сначала эти веса помогают, но в конечном итоге становятся ненужными из-за увеличения количества воды непосредственно над водолазом. Чем больше у него недостаток, тем быстрее они поднимаются. Регулярный лом не только служил бы еще большему весу, привязанному к водолазу, но также и в центре, когда он использовался. Это очень затрудняет эффективное использование.
Американское Геологическое управление подсчитало, что добыча ильменита в мире в 2004 году в целом составила 4.8 млн тонн, в то время как добыча рутила в мире в целом составила 400 000 тонн. Ильменит обеспечивает потребность в титановых минералах в мире на 90%. По подсчетам Американского Геологического управления мировые ресурсы анатаза, рутила и ильменита в общем составляют более двух миллиардов тонн.
Поэтому водолазы и спасатели предпочитают более легкий, менее плотный лом, с равной или большей силой обычного лома, по соображениям безопасности и удобства. То, что вам нужно, это очень легкий лом; достаточно легкий, чтобы подняться с ним, привязанным к вашей упряжке, и достаточно сильным, чтобы вы могли дать действительно хороший кривошип любому подозрительному камню, чтобы бросить те, которые не защищены. Конечно, это делается только при настройке начального маршрута. После того, как маршрут был очищен, он должен быть безопасным для будущих альпинистов и зрителей, но для ранних восхождений титановый лом намного лучше, чем стальной.
Производство
Первый этап в производстве титана заключается в изготовлении губки путем хлорирования руды рутила. Хлор и кокс соединяют с рутилом для создания тетрахлорида титана, который затем в замкнутой системе соединяют с магнием для производства титановой губки и хлорида магния. Магний и хлорид магния извлекают для переработки путем использования вакуумного дистилляционного процесса или технологического процесса выщелачивания, создателем которого является Кроль. Основными производителями титановой губки являются США, Россия, Казахстан, Украина, Япония и Китай.
Вакуумная сепарация реакционной массы
Титановый лом с специально шлифованным и полированным краем был инструментом, который позволил нам иметь установку, которая была практически постоянной, но ее можно было поместить или удалить по желанию. Когда устройство нужно было переместить, один инженер использовал бы лом, чтобы вытащить магнит из корабля, а другой - захватить оборудование и потянуть его против магнитной силы. Без титанового лома эти магниты застряли бы навсегда.
С уважением, Джефф Дженнингс. Названный в честь титанов греческой мифологии, титан - это твердый, блестящий белый металл. Он очень устойчив к коррозии и обычно не подвержен воздействию воздуха, воды, кислот или оснований. Титан очень распространен в земной коре, являясь 9-м наиболее распространенным элементом. Это также распространено в метеоритах, Солнце и Луне. Спектры оксида титана используются астрономами для определения холодных красных карликовых звезд. Титан имеет много применений, в химическом производстве и где нужны легкие, сильные сплавы.
Метод вакуумно-дугового переплава или электронно-лучевая холодная подовая печь используются для плавки губки со скрапом и/или легирующими элементами, такими как ванадий, алюминий, молибден, олово и цирконий для производства переплавленных электродов. Данные электроды можно вновь переплавить методом вакуумно-дугового переплава для производства материала по наиболее строгим спецификациям в авиакосмической сфере и в сфере высоких технологий, или их можно отлить прямо в слябы.
Титан прочный, как сталь, но на 45% легче. Его высокая температура плавления полезна в высокотемпературных приложениях, где важно вес, особенно в двигателях и других частях самолетов и космических аппаратов. Титан устойчив к коррозии морской воды, поэтому он популярен для применений, которые постоянно подвергаются воздействию моря. Бывший Советский Союз построил несколько из своих подводных корпусов из титана, создавая очень сильные и очень дорогие подводные лодки. Диоксид титана используется в качестве красителя в некоторых белых красках и в качестве желтой пищевой добавки.
Слитки ВДП имеют цилиндрическую форму и могут весить до 7.94 тонн. Их куют для изготовления слябов или биллетов или используют для прецизионного литья. Методом прокатки производят плиты, листы прутки, стержни и проволоку. Трубы производят из нарезанных из листов штрипсов.
Применение
В повседневной жизни титан обычно ассоциируется с ценными изделиями, такими как наручные часы, оправы для очков, спортивные товары и ювелирные изделия, но кроме этого он широко используется в авиации, а также в других областях, в которых титан, благодаря сочетанию своих физических свойств и био-совместимости, имеет преимущества перед другими металлами. В зависимости от непосредственного назначения, титан конкурирует с никелем, нержавеющей сталью и циркониевыми сплавами.
Он также непрозрачен для ультрафиолетового света и часто используется в солнцезащитных лосьонах. Титан используется в фейерверках из-за цветов, которые он производит при его сжигании. Титан - единственный элемент, который будет гореть в атмосфере чистого азота.
Титан не имеет биологического применения у людей, хотя известно, что он действует как стимулятор. На некоторых заводах титан используется в производстве химической энергии. Никаких известных преимуществ для жизненных процессов у животных; имеет некоторые незначительные преимущества для здоровья в растениях.
Многообещающие признаки роста показывает автомобильный сектор. В системах подвесок, например, замена стальных пружин на титановые дает преимущество в виде уменьшения веса на 60%. Также титан применяют в производстве коленчатых валов, соединительных тяг и выхлопных систем. Электростанции и заводы по опреснению морской воды также являются важными областями для роста применения титана. В то же время идет развитие производства титановых подложек для компьютерных жестких дисков.
Титан главным образом получают из минералов рутила, ильменита и редко из анатаза. Другие титансодержащие минералы включают перовскит, сфен и титанит. Эти минералы противостоят выветриванию и сосредоточены в россыпи и ветряных песках. Титан добывается в Австралии, Сьерра-Леоне, Южной Африке, России и Японии. Ильменит - общий минерал на Луне. Любые будущие поселения на Луне, вероятно, будут использовать титан в качестве основного строительного материала.
Обработка титана, извлечение титана из его руд и подготовка титановых сплавов или соединений для использования в различных продуктах. Тем не менее, Хантер показал, что металл обладает некоторой пластичностью, и его метод его получения путем взаимодействия тетрахлорида титана с натрием под вакуумом позднее был коммерциализирован и теперь известен как процесс Хантера.
Титан как элемент открыт в 1791 г. Его промышленное производство началось в 50-х годах XX века и получило быстрое развитие. Титановые сплавы имеют наиболее высокую удельную прочность среди всех металлических материалов, а также высокую жаропрочность и коррозионную стойкость и находят все более широкое применение в авиационной технике, химическом машиностроении и других областях техники. Титан используют для легирования сталей. Двуокись титана TiO 2 используют для производства титановых белил и эмалей; карбид титана TiC - для особо твердых инструментальных сплавов.
Губка измельчается, а металл и соли разделяются либо разбавленным кислотным выщелачиванием, либо высокотемпературной вакуумной дистилляцией. Соли рециркулируют через электролитические ячейки для получения натрия или магния для повторного использования в восстановлении металлов и хлора для повторного использования при хлорировании руды. В этом случае титановая губка собирается на стальном катоде, а газообразный хлор выделяется на углеродном аноде.
Необходимое использование в этом процессе солей с высокой температурой плавления в сочетании с необходимостью поддержания инертной среды представляет собой серьезные технические и экономические трудности, которые необходимо преодолеть для достижения коммерческого статуса. Конверсия очищенной титановой губки в форму, пригодную для структурных целей, включает в себя несколько этапов. Консолидация в титановый слиток осуществляется в вакууме или в атмосфере аргона с помощью процесса дуговой плавки с использованием электродов. легирующие элементы, а в некоторых случаях рециркулированный лом сначала механически уплотняют и затем приварены к длинному цилиндрическому электроду.
Титан по распространению в природе занимает четвертое место среди металлов и входит в состав более чем 70 минералов. К основным промышленным титаносодержащим минералам относятся рутил (более 90% ТiO 2) и ильменит TiO 2 -FeO (60%TiO 2). Ильменит входит в состав титаномагнетитов - его смеси с магнитным железняком; они содержат до 20% ТiO 2 . К перспективным рудам относятся сфен CaO-SiO 2 -TiO2 (32-42% TiO 2) и перовскит СаО- TiO (60% ТiO 2).
Электрод расплавляется вертикально в водяной охлажденный медный тигель, проходя через него. Для обеспечения легирующих элементов этот первичный слиток переплавляется по меньшей мере один раз аналогичным образом. Плавление холодного очага представляет собой альтернативный процесс консолидации, который проводится внутри аргоновой или вакуумной камеры, содержащей водный охлажденный горизонтальный медный тигель. Расплавленный металл течет по горизонтальной траектории по кромке пода в подходящую форму с водяным охлаждением медной формы.
Сырьем для получения титана являются титаномагнетитовые руды, из которых выделяют ильменитовый концентрат, содержащий 40 ... 45 % ТiO 2 , -30 % FеО, 20 % Fе 2 О 3 и 5 ... 7 % пустой породы. Название этот концентрат получил по наличию в нем минерала ильменита FеО-ТiO 2 .
Ильменитовый концентрат плавят в смеси с древесным углем, антрацитом, где оксиды железа и титана восстанавливаются. Образующееся железо науглероживается, и получается чугун, а низшие оксиды титана переходят в шлак. Чугун и шлак - разливают отдельно в изложницы. Основной продукт этого процесса - титановый шлак - содержит 80 ... 90 % ТiO 2 , 2 ... 5 % FеО и примеси SiO 2 , А1 2 О 3 , СаО и др. Побочный продукт этого процесса - чугун - используют в металлургическом производстве.
Процесс холодного очага хорошо подходит для отделения загрязняющих веществ высокой плотности, которые оседают на дно очага. По этой причине он используется, прежде всего, для утилизации титанового лома, который может содержать остатки карбидных инструментов, оставшиеся от операций механической обработки.
Консолидированные слитки перерабатываются в мельничные продукты, такие как брусок, заготовка, проволока, трубы, плита и лист традиционными стальными установками. Основным препятствием для более широкого использования является низкая пластичность. Довольно красивые цвета для титановых украшений. В критических применениях сварные швы, демонстрирующие такие цвета, могут иметь пониженную прочность и потерю пластичности и могут быть отклонены.
Полученный титановый шлак подвергают хлорированию в специальных печах. В нижней части печи располагают угольную насадку, нагревающуюся при пропус-кании через нее электрического тока. В печь подают брикеты титанового шлака, а через фурмы внутрь печи - хлор. При температуре 800 ... 1250 °С в присутствии углерода образуется четыреххлористый титан, а также хлориды СаС1 2> МgС1 2 и др.:
Короче говоря, титан примерно на 45 процентов легче стали, на 60 процентов тяжелее алюминия и более чем в три раза сильнее любого из них. В то время как дорогостоящий изначально, титан снижает стоимость жизненного цикла из-за его длительного срока службы и снижения затрат на техническое обслуживание и ремонт.
В дополнение к военным применениям другие распространенные виды использования этого легкого, прочного и коррозионно-стойкого металла включают в себя оборудование для аэрокосмических, морских, химических установок, технологических установок, производства электроэнергии, добычи нефти и газа, медицинского и спортивного снаряжения.
ТiO 2 + 2С + 2С1 2 = ТiСl + 2СО.
Четыреххлористый титан отделяется и очищается от остальных хлоридов благодаря различию температуры кипения этих хлоридов методом ректификации в специальиых установках.
Титан из четыреххлористого титана восстанавливают в реакторах при температуре 950 ... 1000 °С. В реактор загружают чушковый магний; после откачки воздуха и заполнения полости реактора аргоном внутрь его подают парообразный четыреххлористый титан. Между жидким магнием и четыреххлористым титаном происходит реакция
Титан попадает в семейство металлов, называемых реактивными металлами, что означает, что они имеют сильное сродство к кислороду. При комнатной температуре титан реагирует с кислородом с образованием диоксида титана. Это пассивное, непроницаемое покрытие сопротивляется дальнейшему взаимодействию с окружающей атмосферой и придает титану известную коррозионную стойкость. Перед сваркой оксидный слой необходимо удалить, поскольку он плавится при гораздо более высокой температуре, чем основной металл, и потому, что оксид может попасть в расплавленный сварочный бассейн, создать разрывы и уменьшить целостность сварного шва.
ТiС1 2 = Тi + 2МgС1 2 .
Производство титана является технически сложным процессом. Двуокись титана TiO 2 - химически прочное соединение. Металлический титан (t ПЛ = 1725 °С), обладает большой активностью. Он бурно реагирует с азотом при температуре 500-600 °С и кислородом воздуха при 1200-1300 °С, поглощает водород, взаимодействует с углеродом и т. д. Наиболее широкое распространение получил магниетермический способ, осуществляемый по следующей технологической схеме: титановая руда ® обогащение ® плавка на титановый шлак ® получение четыреххлористого титана TiCl 4 ® восстановление титана магнием.
При нагревании титан становится очень реакционноспособным и легко сочетается с кислородом, азотом, водородом и углеродом с образованием оксидов. Интерстициальное поглощение этих оксидов обмакивает сварку и может сделать часть бесполезной. Одна из наиболее распространенных ошибок при сварке титана не проверяет многие переменные, которые способствуют хорошему покрытию защитного газа перед ударом первой дуги. Перед началом каждой «реальной» сварочной сессии сделайте практикой всегда сваривать пробный образец.
Чистота газа варьируется в зависимости от применения. Загрязнение от масла на пальцах, смазочные материалы, режущая жидкость, краска, грязь и многие другие вещества также вызывает охрупчивание, и это является основной причиной отказа сварного шва. Держите чистую рабочую зону, свободную от пыли, мусора и избыточного движения воздуха, которые могут помешать экранирующему газу.
Обогащение титановых руд. Титаномагнетиты и другие бедные руды обогащают электромагнитным и другими способами, получая концентрат, содержащий до 50 % TiO 2 и около 35 % Fe 2 O 3 и FeO.
Плавку на титановый шлак проводят в электродуговой печи. Шихтой служат прессованные брикеты, состоящие из мелкоизмельченного концентрата, антрацита или угля и связующего (сульфитный щелок). В результате плавки получают богатый титановый шлак, содержащий до 80 % TiO 2 . Побочным продуктом является чугун, содержащий до 0,5 % Ti. Измельченный шлак подвергают магнитной сепарации (для удаления железосодержащих частиц), смешивают с мелким нефтяным коксом и связующим и спрессовывают в брикеты. После обжига при 700-800 °С брикеты направляют на хлорирование.
Очистите детали из основного металла и мешка, которые не сразу сварили, очистите шток наполнителя и износите нитриловые перчатки при работе с наполнителем и деталями. Различные марки учитывают потребность в различных комбинациях механических свойств, коррозионной стойкости, формуемости, легкости изготовления и свариваемости. Хотя различные свойства этих сортов могут быть несколько подавляющими, сварка титана относительно похожа на другие сплавы.
Следующие изображения и рекомендации демонстрируют основные рекомендации по сварке титана, расширяя приведенные выше рекомендации и информацию. Отверстия в сварочном столе позволяют сваривать сварные швы и продувочные блоки в самых разных положениях. Титан разделен на четыре класса: коммерчески чистый, альфа, альфа-бета и бета. «Альфа» и «бета» относятся к фазам кристаллической структуры металла при различных температурах. Добавление в сплав кислорода, железа, алюминия, ванадия и других элементов может точно контролировать кристаллическую структуру и, следовательно, свойства сплава.
Получение четыреххлористого титана TiCl 4 в герметизированных электрических печах представлено на рис. 2.9.
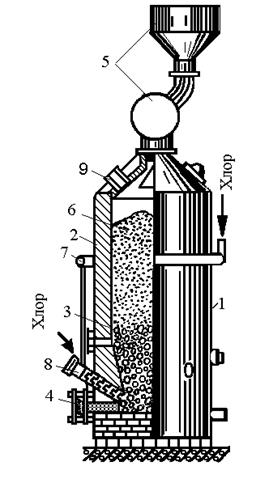
Нижнюю часть печи заполняют угольной (графитовой) насадкой, которая служит электрическим сопротивлением и нагревается при пропускании электрического тока. В реакционной зоне печи выше уровня угольной насадки развивается температура 800…850 °С. При хлорировании образуется четыреххлористый титан по реакции TiO 2 +2C-T2Cl 2 =TiCl 4 +2CO. Пары четыреххлористого титана находятся в паро-газовой смеси, содержащей SiCl 4 и другие хлориды; СО, С1 2 и другие газы.
Ее очищают от твердых частиц и охлаждают в конденсаторах, в результате чего получают жидкий четыреххлористый титан. Для более полной очистки от твердых частиц конденсат отстаивают и фильтруют.
Четыреххлористый титан отделяют от других хлоридов путем ректификации конденсата, основанной на различии температур кипения различных хлоридов. Жидкий четыреххлористый титан направляют на восстановление.
В настоящее время для получения четыреххлористого титана начинают применять другие способы хлорирования: в хлоратоpax непрерывного действия, в солевом расплаве; перспективным является хлорирование в кипящем слое.
Восстановление титана магнием из TiCl 4 проводят в герметичных реакторах (ретортах) из нержавеющей стали, установленных в электрических печах сопротивления. После установки в печь из реторты откачивают воздух и заполняют ее очищенным аргоном; после нагрева до температуры 700° С заливают расплавленный магний и начинают подачу жидкого TiCl 4 . Титан восстанавливается магнием по реакции TiCl 4 +2Mg=Ti+2MgCl 2 . Эта реакция сопровождается выделением большого количества тепла и в реакторе поддерживается необходимая температура 800…900 °С без дополнительного нагрева за счет регулирования скорости подачи TiCl 4 . Частицы восстановленного титана спекаются в пористую массу (титановая губка), пропитанную магнием и хлористым магнием. Расплав хлористого магния периодически удаляют через патрубок в дне реактора. В промышленных реакторах (емкостью до 2 т) получают титановую губку, содержащую до 60% Ti, 30 °/o Mg и 10 % MgCl 2.
Рафинирование титановой губки производят методом вакуумной дистилляции. Крышку охладившейся реторты снимают и вместо нее устанавливают водоохлаждаемый конденсатор; затем реторту снова устанавливают в печь. Дистилляция проводится при 950…1000 °С и вакууме около 10 -3 мм рт. ст. Примеси титановой губки Mg и MgCl 2 расплавляются, частично испаряются и затем выделяются в конденсаторах. Получаемый оборотный магний возвращается в производство, MgCl 2 используют для производства магния.
Получение титановых слитков . Титановые слитки получают переплавкой титановой губки в вакуумных электрических дуговых печах. Расходуемый электрод изготавливают прессованием из измельченной титановой губки. Электрическая дуга горит между расходуемым электродом и ванной расплавленного металла, постепенно заполняющего изложницу, затвердевающего и образующего слиток.
Наличие вакуума предохраняет металл от окисления и способствует его очистке от поглощенных газов и примесей.
Для получения слитков может быть использована дробленая титановая губка, загружаемая в печь дозатором. В этом случае дуга горит между расплавленным металлом и графитовым электродом, поднимаемым по мере заполнения изложницы металлом.
Для обеспечения высокого качества слитков плавку повторяют два раза. При второй плавке расходуемым электродом служит слиток, полученный при первой плавке.
Титановые сплавы выплавляют в электрических дуговых вакуумных печах, аналогичных применяемым для переплавки титановой губки. В качестве шихтовых материалов используют титановую губку и легирующие элементы в соответствии с заданным химическим составом сплава. Из шихты прессованием при 280….330 °С изготавливают переплавляемый (расходуемый) электрод. Плавку ведут в вакууме или в атмосфере аргона. Перед началом плавки на поддон в качестве затравки насыпают слой стружки из сплава такого же состава. Для более равномерного распределения легирующих элементов в сплаве полученный слиток переплавляют вторично.
Натриетермический способ получения титана отличается от магниетермического тем, что титан из TiCl 4 восстанавливают металлическим натрием. Этот процесс проводят при относительно невысокой температуре, и титан в меньшей степени загрязняется примесями. Вместе с тем натриетермический способ технически более сложен.
Кальциееидридный способ основан на том, что при взаимодействии двуокиси титана TiO 2 с гидридом кальция СаН 2 образуется гидрид титана ТiH2, из которого затем выделяется металлический титан. Недостаток этого способа состоит в том, что получаемый титан сильно загрязнен примесями.
Иодидный способ применяют для получения небольших количеств титана очень высокой чистоты, до 99,99%. Он основан на реакции Ti+2I 2 « TiI 4 , которая при 100 …200 °С идет слева направо (образование Til 4), при 1300…1400 °С -в обратном направлении (разложение ТiI 4).
Рафинируемую титановую губку помещают в реторту и нагревают до 100…200 °С; внутрь реторты вводят и разбивают ампулу с йодом, взаимодействующим с титаном по реакции Ti+2I 2 ® TiI 4 . Разложение TiI 4 ® Ti+2I 2 и выделение титана происходит на титановых проволоках, натянутых в реторте, нагретых до 1300… 1400 °С пропусканием тока.




