Мембранные белки. Структура мембранных белков клеток. Белки мембран - интегральные, поверхностные, «заякоренные». Значение посттрансляционных модификаций в образовании функциональных мембранных белков
глубоко проникать в липидный бислой или даже пронизывать его - интегральные белки Некоторые из трансмембранных белков пронизывают мембрану один раз (гликофорин), другие имеют несколько участков (доменов), последовательно пересекающих бислой
Трансмембранные домены, пронизывающие бислой, имеют конформацию α-спирали. Полярные остатки аминокислот обращены внутрь глобулы,а неполярные контактируют с мембранными липидами. Такие белки называют "вывернутыми" по сравнению с растворимыми в воде белками, в которых большинство гидрофобных остатков аминокислот спрятано внутрь, а гидрофильные располагаются на поверхности
Радикалы заряженных аминокислот в составе этих доменов лишены заряда и протонированы (-СООН) или депротонированы (-NH 2).
прикрепляться к мембране - поверхностные белки.
Поверхностные белки часто прикрепляются к мембране, взаимодействуя с интегральными белками или поверхностными участками липидного слоя. Поверхностные белки или домены интегральных белков, расположенные на наружной поверхности всех мембран, почти всегда гликозилированы. Олигосахаридные остатки могут быть присоединены через амидную группу аспарагина или гидроксильные группы серина и треонина
Закрепление с помощью мембранного "якоря"
"Якорем" может быть неполярный домен белка, построенный из аминокислот с гидрофобными радикалами. Примером такого белка может служить цитохром b 5 мембраны ЭР. Этот белок участвует в окислительно-восстановительных реакциях, как переносчик электронов
Роль мембранного "якоря" может выполнять также ковалентно связанный с белком остаток жирной кислоты). Белки, связанные с жирными кислотами, локализованы в основном на внутренней поверхности плазматической мембраны. Миристиновая кислота присоединяется к N-концевому глицину с образованием амидной связи. Пальмитиновая кислота образует тиоэфирную связь с цистеином или сложноэфирную с остатками серина и треонина.
Небольшая группа белков может взаимодействовать с наружной поверхностью клетки с помощью ковалентно присоединённого к С-концу белка фосфатидилинозитолгликана. Этот "якорь" - часто единственное связующее звено между белком и мембраной, поэтому при действии фосфолипазы С этот белок отделяется от мембраны.
44.Механизмы переноса веществ через мембраны: простая диффузия, первично-активный транспорт (Na-K-АТФаза, Са-АТФаза), пассивный симпорт и антипорт. Вторично-активный транспорт, регулируемые каналы (Са-канал эндоплазматического ретикулума).
Простая диффузия осуществляется за счет теплового движения молекул из зоны с большей концентрацией в зону с меньшей концентрацией. Разность концентраций по обе стороны мембраны называется градиентом концентраций. При переносе заряженных частиц важную роль играет разница потенциалов. Обычно внутри клетки накапливаются отрицательно заряженные частицы. Таким путем транспортируются: Н 2 О, СО 2 , О 2 . Перенос веществ простой диффузией прекращается когда концентрация вещества с одной и с другой стороны мембраны выравнивается.
первично-активный транспорт-перенос в-в против градиента концентрации с затратой энергии
NA-К-Атфаза-ответственна за одновременный перенос натрия наружу(3), калия внутрь(2)
кальций-атфаза-ответствена за перенос кальция наружу
Вторично-активный транспорт. Активный перенос вещества через мембрану может осуществляться за счет энергии градиента концентрации другого вещества. Переносчик в этом случае имеет специфические центры связывания для обоих веществ (Присоединение и отделение переносимого вещества вызывает изменения конформации переносчика, и соответственно - изменения сродства к переносимым веществам. Если концентрация вещества X снаружи больше, чем внутри, оно может перемещаться путем облегченной диффузии. Переносчик имеет центр связывания и для вещества Y, которое транспортируется попутно с веществом X (симпорт), причем вещество Y может транспортироваться против градиента своей концентрации. Сходным образом происходит и антипорт - перемещение вещества против градиента своей концентрации в направлении, противоположном перемещению другого вещества по его градиенту концентрации
Симпорт и антипорт могут происходить за счет энергии градиента концентрации ионов Na+, создаваемого Na,K-AT-Фазой. Таким способом происходит, например, всасывание аминокислот из кишечника и глюкозы из первичной мочи и кишечника. Следовательно, в этих случаях первичным источником энергии служит АТФ: сначала энергия гидролиза АТФ трансформируется в энергию трансмембранного градиента концентрации Na+, а затем энергия этого градиента используется для переноса аминокислот или глюкозы.
Открытие или закрытие селективных каналов регулируется либо изменением концентрации специфических регуляторов, таких как медиаторы, гормоны, циклические нуклеотиды, NO, G-белки, либо изменением трансмембранного электрохимического потенциала (рис. 5-14). Воздействие регуляторного фактора вызывает конформационные изменения каналообразующих белков, канал открывается и ионы проходят по градиенту концентрации. Транспорт веществ через каналы не приводит к конформационным изменениям белков и зависит только от разности концентраций веществ по обе стороны мембраны. Поэтому скорость транспорта веществ через такие каналы может достигать 10 6 -10 8 ионов в секунду.
Cтраница 1
Интегральные белки, подобно липидам, обладают амфипатическими свойствами: у них есть гидрофобные области, взаимодействующие с гидрофобными радикалами липидных молекул внутри бислоя, и гидрофильные, обращенные с обеих сторон мембраны к воде.
Интегральные белки имеют на своей поверхности большие гидрофобные участки и располагаются внутри мембраны. Для выделения интегральных белков необходимо сначала разрушить липидный бислой.
Интегральные белки пронизывают мембрану насквозь, они удерживаются с помощью электростатических сил, возникающих при взаимодействии гидрофильных аминокислот с полярными головками фосфолипидов.
Интегральные белки полностью погружены в мембрану, а иногда пронизывают ее насквозь. Связь интегральных белков с мембранными липидами очень прочна и определяется главным образом гидрофобными взаимодействиями. Периферические белки частично погружены в гидрофобную область, а поверхностные находятся вне ее. В первом случае связь с липидами в основном, а во втором - исключительно определяется электростатическими взаимодействиями. Помимо этого некоторые белки и липиды в мембране могут быть связаны ковалентно.
Особенность интегральных белков - наличие в их полипептидной цепи довольно протяженных участков с преобладающим содержанием неполярных аминокислот. Как правило, эти участки имеют конформацию а-спирали, на наружной стороне к-рой расположены боковые углеводородные фрагменты аминокислотных остатков, в результате чего вся спираль, в целом, приобретает гидрофобный характер. Доля а-спиральных участков в мембранных белках довольно велика (составляет 30 - 50 %), остальная часть полипептидной цепи находится преим. Участков с р-структурой, как правило, мало.
Солюбилизация интегральных белков может проводиться с использованием органических растворителей, хаотропных веществ и детергентов. Применение органических растворитепей для извлечения липидов и освобождения интегральных белков в настоящее время является весьма ограниченным, поскольку такая обработка часто и активирует мембранные белки. Хаотропные вещества, вызывающие нарушение упорядоченной структуры воды, тоже разрушают липидный бислой. Однако и они применяются довольно радко, так как их солюбилизирующая эффективность в большинстве случаев очень мала.
Адрено-рецепторы - связанные с мембраной интегральные белки [ Wikberg J.
В двойной слой липидов погружены интегральные белки. Периферические белки только примыкают к поверхности мембраны.
В двойной слой липидов встроены белки-так называемые интегральные белки мембран. Они плавают в этом слое, будучи погружены в него частично, или же пронизывают его насквозь. Некоторые мембраны, по-видимому, с одной или с обеих сторон покрыты сетью вытянутых белковых молекул.
Одним из главных препятствий при структурном изучении интегральных белков биологических мембран является их низкая растворимость. Мембранные белки практически нерастворимы в водных буферных системах, и это фактически исключает использование протеолитических ферментов в традиционной форме.
Биология и генетика
Мембранные белки контактирующие с гидрофобной частью липидного бислоя должны быть амфифильными. Белки мембран различаются по своему положению в мембране. Они могут глубоко проникать в липидный бислой или даже пронизывать его интегральные белки либо разными способами прикрепляться к мембране поверхностные белки. Поверхностные белки.
Белки мембран - интегральные, поверхностные, «заякоренные». Значение посттрансляционных модификаций в образовании функциональных мембранных белков.
Мембранные белки, контактирующие с гидрофобной частью липидного бислоя, должны быть амфифильными. Те участки белка, которые взаимодействуют с углеводородными цепями жирных кислот, содержат преимущественно неполярные аминокислоты. Участки белка, находящиеся в области полярных "головок", обогащены гидрофильными аминокислотными остатками. Белки мембран различаются по своему положению в мембране. Они могут глубоко проникать в липидный бислой или даже пронизывать его - интегральные белки, либо разными способами прикрепляться к мембране - поверхностные белки.
Поверхностные белки. Поверхностные белки часто прикрепляются к мембране, взаимодействуя с интегральными белками или поверхностными участками липидного слоя.
Белки, образующие комплексы с интегральными белками мембраны. Ряд пищеварительных ферментов, участвующих в гидролизе крахмала и белков, прикрепляется к интегральным белкам мембран микроворсинок кишечника. Примерами таких комплексов могут быть са-хараза-изомальтаза и мальтаза-гликоамилаза. Возможно, связь этих пищеварительных ферментов с мембраной позволяет с высокой скоростью гидролизовать субстраты и усваивать продукты гидролиза клеткой.
Белки, связанные с полярными «головками» липидов мембран. Полярные или заряженные домены белковой молекулы могут взаимодействовать с полярными "головками" липидов, образуя ионные и водородные связи. Кроме того, множество растворимых в цитозоле белков при определённых условиях могут связываться с поверхностью мембраны на непродолжительное время. Иногда связывание белка - необходимое условие проявления ферментативной активности. К таким белкам, например, относят протеинкиназу С, факторы свёртывания крови.
Закрепление с помощью мембранного "якоря". "Якорем" может быть неполярный домен белка, построенный из аминокислот с гидрофобными радикалами. Примером такого белка может служить цитохром b5 мембраны ЭР. Этот белок участвует в окислительно-восстановительных реакциях, как переносчик электронов Роль мембранного "якоря" может выполнять также ковалентно связанный с белком остаток жирной кислоты (миристиновой - С14 или пальмитиновой - С16). Белки, связанные с жирными кислотами, локализованы в основном на внутренней поверхности плазматической мембраны. Миристиновая кислота присоединяется к N-концевому глицину с образованием амидной связи. Пальмитиновая кислота образует тиоэфирную связь с цистеином или сложноэфирную с остатками серина и треонина. Небольшая группа белков может взаимодействовать с наружной поверхностью клетки с помощью ковалентно присоединённого к С-концу белка фосфатидилинозитолгликана. Этот "якорь" - часто единственное связующее звено между белком и мембраной, поэтому при действии фосфолипазы С этот белок отделяется от мембраны.
Трансмембранные (интегральные) белки. Некоторые из трансмембранных белков пронизывают мембрану один раз (гликофорин), другие имеют несколько участков (доменов), последовательно пересекающих бислой Трансмембранные домены, пронизывающие бислой, имеют конформацию α-спирали. Полярные остатки аминокислот обращены внутрь глобулы, а неполярные контактируют с мембранными липидами. Такие белки называют "вывернутыми" по сравнению с растворимыми в воде белками, в которых большинство гидрофобных остатков аминокислот спрятано внутрь, а гидрофильные располагаются на поверхности. Радикалы заряженных аминокислот в составе этих доменов лишены заряда и протонированы (-СООН) или депротонированы (-NH2)
Гликозилированные белки. Поверхностные белки или домены интегральных белков, расположенные на наружной поверхности всех мембран, почти всегда гликозилированы. Олигосахаридные остатки могут быть присоединены через амидную группу аспарагина или гидроксильные группы серина и треонина. Олигосахаридные остатки защищают белок от протеолиза, участвуют в узнавании лигандов или адгезии.
А также другие работы, которые могут Вас заинтересовать |
|||
| 76933. | Бранхиогенные железы | 180.89 KB | |
| Внутри железы находятся дольки лежащие между фиброзными перегородками трабекулами. Размеры железы: поперечный 3060 мм продольный 50 мм высота перешейка 515 мм; масса железы 2530 г. Паращитовидные железы гландула паратиреоидеа верхние и нижние овальные тельца длиной 48 мм шириной 34 мм толщиной 23 мм. | |||
| 76934. | Неврогенные железы внутренней секреции: гипофиз, мозговое вещество надпочечника, и шишковидная железа – их строение, топография, функция, развитие | 186.73 KB | |
| Эта энтодермальная структура растет в сторону головного мозга и его третьего желудочка проходя через формирующийся интраклиновидный синхондроз и его канал в полость черепа. Над гипофизом в нижней части промежуточного мозга располагается гипоталамус в составе зрительного перекреста зрительных трактов серого бугра с воронкой сосцевидных тел. Эпифиз входит в состав эпиталамической области промежуточного мозга и связан со зрительными буграми поводками и их треугольниками спайками. Он располагается в широкой борозде между верхними холмиками... | |||
| 76935. | Железы адреналовой системы | 178.87 KB | |
| Интерреналовые тельца добавочные надпочечники возникают при развитии почек и надпочечников. Закладка располагается в задней стенке целома между первичными почками и возникает из мезодермальных клеток образующих корковое вещество почек и надпочечников. Мозговое вещество располагается в центре надпочечников и состоит из крупных клеток окрашиваемых солями хрома. | |||
| 76936. | Надпочечники. Происхождение и развитие гландула супрареналис | 180.63 KB | |
| Из него развивается интерреналовая ткань которая дифференцируется в корковое вещество и добавочные надпочечники. В связи с тем что корковое вещество и гонады развиваются из общего источника мочеполовая складка между ними сохраняется структурная близость и функциональная взаимосвязь проявляющаяся выработкой половых гормонов в сетчатой зоне коры надпочечников. Под капсулой располагается корковое вещество состоящее из: клубочковой зоны вырабатывающей гормоны минералокортикоиды: альдостерон кортикостерон дезоксикортикостерон... | |||
| 76937. | Сосуды малого круга | 180.57 KB | |
| Внутри легких артерии ветвятся также как и бронхи пока не возникает вокруг легочного ацинуса микрососудистое русло из которого путем последовательного слияния венул интраорганных вен возникают крупные легочные вены. В воротах легких на одну легочную артерию приходится две легочные вены: верхняя и нижняя. Легочные вены всего четыре пройдя через перикард вливаются в левое предсердие где и заканчивается малый круг. | |||
| 76938. | Аорта и ее отделы. Ветви дуги аорты и ее грудного отдела (париетальные и висцеральные) | 183.06 KB | |
| Ветви дуги аорты и ее грудного отдела париетальные и висцеральные. Она начинается из левого желудочка восходящей частью аорта асценденс переходящей в дугу аркус а далее в нисходящую часть аорта десценденс которая на уровне IVV поясничных позвонков делится бифуркация аорты на правую и левую общие подвздошные артерии. Луковица возникает изза того что аортальные синусы: правый левый задний как бы выпирают стенку аорты кнаружи в поперечнике она имеет 253 см. Аортальные синусы 3 вместе с полулунными заслонками 3 образуют... | |||
| 76939. | Париетальные и висцеральные (парные и непарные) ветви брюшной аорты. Особенности их ветвления и анастомозы | 183.28 KB | |
| Брюшная аорта лежит за брюшиной вдоль передней и левой поверхности поясничного позвоночника повторяя его изгиб кпереди лордоз и разделяясь на уровне IVV позвонков на общие подвздошные артерии: правую и левую. Париетальные ветви брюшной аорты парные правые и левые: нижние диафрагмальные артерии с верхними надпочечниковыми ветвями 124 с началом на уровне аортальной щели диафрагмы; поясничные артерии с дорсальными спинными кожномышечными и спинномозговыми ветвями. Париетальные ветви анастомозируют между собой в задней брюшной... | |||
| 76940. | Подвздошные артерии | 182.17 KB | |
| Общая подвздошная артерия (a. iliaca communis): правая и левая - магистральные артерии с диаметром в 1,1-1,2 см - начинаются на уровне IV-V поясничных позвонков (бифуркация аорты), направляются в малый таз, боковых ветвей не имеют и на уровне крестцово-подвздошных суставов разделяются на внутреннюю и наружную подвздошные артерии: правые и левые. | |||
Классификация
Мембранные белки могут быть классифицированы по топологическому или биохимическому принципу. Топологическая классификация основана на локализации белка по отношению к липидному бислою. Биохимическая классификация основана на прочности взаимодействия белка с мембраной.
Различные категории политопических белков. Связывание с мембраной за счёт (1) единичной трансмембранной альфа-спирали, (2) множественных трансмембранных альфа-спиралей, (3) бета-складчатой структуры.
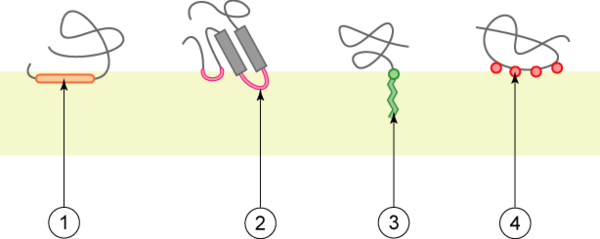
Различные категории интегральных монотопических белков. Связывание с мембраной за счёт (1) амфипатической альфа-спирали, параллельной плоскости мембраны, (2) гидрофобной петли, (3) ковалентно соединённого жирнокислотного остатка, (4) электростатического взаимодействия (прямого или кальций -опосредованного).
Топологическая классификация
По отношению к мембране мембранные белки делятся на поли- и монотопические.
- Политопические, или трансмембранные, белки полностью пронизывают мембрану и, таким образом, взаимодействуют с обеими сторонами липидного бислоя. Как правило, трансмембранный фрагмент белка является альфа-спиралью , состоящей из гидрофобных аминокислот (возможно от 1 до 20 таких фрагментов). Только у бактерий , а также в митохондриях и хлоропластах трансмембранные фрагменты могут быть организованы как бета-складчатая структура (от 8 до 22 поворотов полипептидной цепи).
- Интегральные монотопические белки постоянно встроены в липидный бислой, но соединены с мембраной только на одной стороне, не проникая на противоположную сторону.
Биохимическая классификация
По биохимической классификации мембранные белки делятся на интегральные и периферические .
- Интегральные мембранные белки прочно встроены в мембрану и могут быть извлечены из липидного окружения только с помощью детергентов или неполярных растворителей. По отношению к липидному бислою интегральные белки могут быть трансмембранными политопическими или интегральными монотопическими.
- Периферические мембранные белки являются монотопическими белками. Они либо связаны слабыми связями с липидной мембраной, либо ассоциируют с интегральными белками за счёт гидрофобных, электростатических или других нековалентных сил. Таким образом, в отличие от интегральных белков они диссоциируют от мембраны при обработке соответствующим водным раствором (например, с низким или высоким pH, с высокой концентрацией соли или под действием хаотропного агента). Эта диссоциация не требует разрушения мембраны.
Мембранные белки могут быть встроены в мембрану за счёт жирнокислотных или пренильных остатков либо гликозилфосфатидилинозитола , присоединённых к белку в процессе их




