Вода: ее состав, строение молекулы, физические свойства. Химические свойства воды
Состав воды можно выяснить с помощью реакции разложения электрическим током. Образуется два объема водорода на один объем кислорода (объем газа пропорционален количеству вещества):
2H 2 O = 2H 2 + O 2
Вода состоит из молекул. Каждая молекула содержит два атома водорода, соединенные ковалентными связями с одним атомом кислорода. Угол между связями около 105°:
O - H
H
Поскольку кислород является более электроотрицательным элементом (сильным окислителем), общая электронная пара ковалентной связи смещается к атому кислорода, на нем образуется частичный отрицательный заряд δ−, на атомах водорода - частичный положительный δ+. Соседние молекулы притягиваются друг к другу противоположными зарядами - это обуславливает сравнительно высокую температуру кипения воды.
Вода при комнатной температуре - бесцветная прозрачная жидкость. Температура плавления 0º C, температура кипения при атмосферном давлении - 100° С. Чистая вода не проводит электрический ток.
Интересной особенностью воды является то, что она имеет наибольшую плотность 1 г/см 3 при температуре около 4° С . При дальнейшем понижении температуры плотность воды снижается. Поэтому с наступлением зимы верхние замерзающие слои воды становятся легче и не погружаются вниз. Лед образуется на поверхности. Промерзания водоема до дна обычно не происходит (к тому же лед тоже имеет плотность меньше воды и плавает на поверхности).
Химические свойства :
К основным загрязнителям природной воды относятся сточные воды промышленных предприятий, содержащие соединения ртути, мышьяка и других токсичных элементов. Стоки животноводческих комплексов, городов могут содержать отходы, вызывающие бурное развитие бактерий. Большую опасность для природных водоемов представляет неправильное хранение (не обеспечивающее защиту от атмосферных осадков) или применение удобрений и ядохимикатов, смываемых в водоемы. Транспорт, особенно водный, загрязняет водоемы нефтепродуктами и бытовым мусором, выбрасываемым недобросовестными людьми прямо в воду.
Для охраны вод необходимо вводить замкнутое водоснабжение промышленных предприятий, комплексную переработку сырья и отходов, строительство очистных сооружений, экологическое воспитание населения.
* Для электролиза воды используются растворы солей
2. Опыт. Распознавание соли угольной кислоты среди трех предложенных солей.
Качественной реакцией на карбонаты служит взаимодействие с кислотами, сопровождающееся бурным выделением углекислого газа:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2
или, в ионном виде:
CO 3 2− + 2H + = H 2 O + CO 2
Доказать, что выделяется именно оксид углерода (IV), можно, пропуская его через раствор известковой воды, что вызывает её помутнение:
CO 2 + Ca(OH) 2 = CaCO 3 ↓ + H 2 O
Чтобы распознать соль угольной кислоты, добавляем во все три пробирки немного кислоты (чтобы не вылилась через край при «вскипании»). Где будет выделяться бесцветный газ без запаха, там находится карбонат.
Вода занимает особое положение среди природных богатств Земли – она незаменима. Иссякнут запасы металлов – быть может, удастся заменить их пластмассами; не хватит растительных и животных белков – научатся получать синтетические; даже вместо обычного воздуха пригодна в некоторых случаях искусственная смесь газов. Вода будет необходима во все века и всюду, где существуют земные формы жизни.
Отец русской и советской геологии академик А.П. Карпинский писал, что нет более драгоценного ископаемого, чем вода, без которой нельзя жить . Ввиду этого не только для специальных геологоразведовательных целей, а специально для жизни, для земледелия, для всего вода – самое главное ископаемое.
Самый крупный водопотребитель в мире – сельское хозяйство, на втором месте стоят промышленность и энергетика, на третьем – коммунальное хозяйство городов.
Огромное количество воды наших рек и водохранилищ идет на орошение. Часть воды, подаваемая на орошение, возвращается поверхностным и подземным стоком в гидрографическую сеть или море. Безвозвратное водопотребление – наиболее важный показатель изменения водных ресурсов под влиянием орошения. В целом по стране возвратные воды составляют 40% водозабора, а безвозвратное водопотребление – 60% .
Значение воды в химическом производстве и технологии лс.
Вода имеет большое значение в химическом производстве и технологии ЛС. Мы изучали это значение на примере двух предприятий:
ОАО «Гродно Азот»;
ООО «Фармтехнология».
Химическая и фармацевтическая промышленность - одни из крупнейших потребителей воды. Вода используется почти во всех химических и фармацевтических производствах для разнообразных целей. Такое использование воды, объясняется некоторыми свойствами:
наличием комплекса ценных свойств (высокая теплоемкость, малая вязкость, низкая температура кипения и др.);
доступностью и дешевизной (затраты исключительно на извлечение и очистку);
нетоксичностью;
удобством использования в производстве и транспортировке .
Вода в химической промышленности
В химической промышленности вода используется в следующих направлениях:
1. Для технологических целей в качестве:
растворителя твердых, жидких и газообразных веществ;
среды для осуществления физических и механических процессов (флотация, транспортировка твердых материалов в виде пульпы и др.);
промывной жидкости для газов;
экстрагента и абсорбента различных веществ.
2. Как теплоноситель (в виде горячей воды и пара) и хладоагента для обогрева и охлаждения аппаратуры.
3. В качестве сырья и реагента для производства различной химической продукции (например, аммиака, метанола, серной кислоты и олеума, азотной кислоты и жидких азотных удобрений и др.) .
В последнее время перед промышленными предприятиями ставится важная задача – сокращения потребления свежей воды за счет развития оборотного водоснабжения.
В производстве наиболее водоемкими являются: химическая, целлюлозно–бумажная, металлургическая промышленность, пищевая, косметическая, микроэлектронная и т.д.
Основная причина загрязнения водных бассейнов - сброс в водоемы неочищенных или недостаточно очищенных сточных вод промышленными предприятиями коммунальным и сельским хозяйством.
На предприятиях химической промышленности, в том числе на ОАО «Гродно Азот», вода используется в технологии получения аммиака жидкого технического, азотных удобрений (карбамид, карбамидо-аммиачная смесь – КАС, сульфат аммония, аммиачная вода) и капролактама; для охлаждения оборудования, для получения пара . Процессы коррозии связаны с характерными особенностями воды и металла. Вследствие сквозной коррозии теплообменных аппаратов происходит сильное загрязнение воды технологическими продуктами оборотного водоснабжения.
Природную воду очищают различными способами:
От крупных взвешенных нерастворенных частиц воду очищают фильтрованием. Огромные фильтры заполняют толстым слоем песка и гравия.
Растворенные соли удаляют химическим путем.
От тонких взвесей, придающих воде окраску, избавляются от солей алюминия:
3Са(ОН) 2 +Al 2 (SO 4) 3 =2Al(OH) 3 ↓ +2СаSO 4 ; (5)
3Na 2 CO 3 + Al 2 (SO 4) 3 +3H 2 O=2Al(OH) 3 ↓+3Na 2 SO 4 +3CO 2 . (6)
Клейкий осадок гидроксида алюминия захватывает из воды тонкую взвесь, а также бактерии.
После того как вода постоит в огромных отстойниках, где осядут все нерастворенные вещества, производится обеззараживание ее воздействием хлора, озона или ультрафиолетового света.
Тщательно очищенная вода поступает в водопроводную сеть. Для лабораторий, научных учреждений требуется еще более чистая вода. Высокая степень очистки достигается перегонкой воды - так получается дистиллированная вода.
Для очистки также используют искусственные смолы - иониты, пропусканием через которые достигается освобождение воды от катионов и от анионов .
В системах оборотного водоснабжения наблюдается интенсивная коррозия металлов, которые разрушаются вследствие физико-химического взаимодействия.
Растворенные соли испарившейся воды остаются в оборотной воде, повышая их концентрацию. Степень повышения концентрации растворенных веществ (не летучих и не образующих осадка) называют коэффициентом концентрирования или коэффициентом упаривания
На предприятии ОАО «Гродно Азот» очистку сточных вод проводят в отделении нитриденитрификации (НДФ) и доочистку в отделении биологической очистки (БХО).
Без запаха, вкуса и цвета.
Распространение в природе. - одно из самых распространенных на Земле соединений. обнаружены в межзвездном пространстве. входит в состав комет, большинства планет солнечной системы и их спутников. Количество на поверхности Земли оценивается в 1,39*10 18 т, большая часть ее содержится в морях и океанах. Количество доступных для использования пресных в реках, озерах, болотах и водохранилищах составляет 2*10 4 т. Масса ледников Антарктики, Антарктиды и высокогорных районов 2,4*10 16 т, примерно столько же имеется подземных , причем только небольшая их часть - пресные. В глубинных слоях Земли содержится значительно больше (повидимому, не менее, чем на порядок) , чем на поверхности. В находится около 1,3*10 13 т . входит в состав мн. и горных пород (глины, и др.), присутствует в почве, является обязательным компонентом всех живых организмов.
Изотопный состав. Существует 9 устойчивых изотопных разновидностей . Содержание их в пресной в среднем следующее (мол. %): 1 Н 2 16 О - 99,13; 1 Н 2 18 О - 0,2; 1 Н 2 17 0-0,04; 1 Н 2 О 16 О-0,03; остальные пять изотопных разновидностей присутствуют в в ничтожных количествах. Кроме стабильных изотопных разновидностей, в содержится небольшое количество радиоактивного 3 Н 2 (или Т 2 О). Изотопный состав природной разного происхождения несколько варьирует. Особенно непостоянно отношение 1 Н/ 2 Н: в пресных - в среднем 6900, в морской -5500, во льдах - 5500-9000. По физ. свойствам D 2 O заметно отличается от обычной . , содержащая 18 О, по свойствам ближе к с 16 О.
Строение молекулы и физические свойства. и в расположены в углах равнобедренного треугольника с длиной связи О-Н 0,0957 нм; Н-О-Н 104,5°; 6,17*10 -30 Кл*м; 1,45*10 -3 нм 3 ; средний - 1,87*10 -41 Кл*м 2 , энергия ионизации 12,6 эВ, сродство к 7,1 эВ. При взаимодействии с др. , и , в том числе с другими в конденсированных фазах, эти параметры изменяются.
Некоторые параметры, характеризующие свойства в разных агрегатных состояниях при атм. , приведены ниже (см. также табл. 1 и рис. 1, на котором указаны области существования различных модификаций льда):
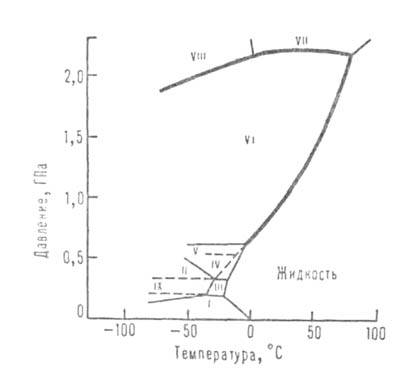
Взаимодействие между молекулами воды. Структура конденсированных фаз. , обладая значительным дипольным моментом, сильно взаимодействуя друг с другом и других веществ. При этом могут образовывать водородные связи с О, N, F, Cl, S и др. В водяном при невысоких температурах и умеренных присутствует небольшое количество (около 1% при температуре и атм. давлении) димеров (для них ~ 15 кДж/моль), расстояние между ~ 0,3 нм. В конденсированных фазах каждая образует четыре водородные связи: две - как донор и две - как акцептор . Средняя длина этих связей в кристаллич. модификациях льда и около 0,28 нм. Угол О-Н...О стремится к 180°. Четыре водородные связи направлены приблизительно к вершинам правильного тетраэдра (рис. 2).
Структура модификаций льда представляет собой трехмерную сетку. В плотных модификациях VI-VIII, устойчивых при высоких , можно даже выделить две такие сетки, "вставленные" одна в другую. В модификациях, существующих при низких (льды Ih и Iс), связи Н-О-Н почти прямолинейны и направлены к вершинам практически правильного тетраэдра. В модификациях II-VI связи искривлены, и углы между ними отличаются от тетраэдрического, что обусловливает увеличение плотности по сравнению с плотностью обычного льда.
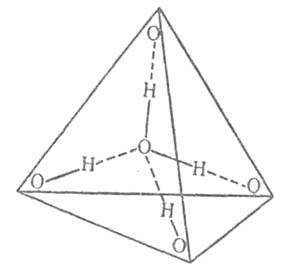
Рис. 2. Схема тетраэдрической координации ; сплошные линии - ; пунктирные линии - водородные связи.
Но плотность модификаций II-VI значительно ниже той, которой мог бы обладать лёд при . Только в модификациях VII и VIII достигается достаточно высокая плотность упаковки: в их структуре две правильные сетки, построенные из тетраэдров (аналогичные существующим в кубическом низкотемпературном льде Iс, изоструктурном алмазу), вставлены одна в другую; при этом сохраняется система прямолинейных водородных связей, а координационное число по удваивается и достигает 8. Расположение во льдах VII и VIII подобно расположению в и многих других . В обычном (Ih) и кубическом (Iс) льдах, а также во льдах HI, V-VII ориентация не определена: оба ближайших к О образуют с ним , которые могут быть направлены к любым двум из четырех соседних в вершинах тетраэдра. Диэлектрическая проницаемость этих модификаций высока (выше, чем у жидкой воды). Модификации II, VIII и IX ориентационно упорядочены; их диэлектрическая проницаемость низка (ок. 3). Лед VIII представляет собой упорядоченный по размещению вариант льда VII, а лед IX - льда III. Плотности ориентационно упорядоченных модификаций (VIII, IX) близки к плотностям соответствующих неупорядоченных (VII, III).
Трехмерная сетка водородных связей, построенная из тетраэдров, существует и в жидкой во всем интервале от температуры до критической. Увеличение плотности при , как и в случае плотных модификаций льда, объясняется искривлением водородных связей и отклонением углов между ними от тетраэдрических. Искривление связей увеличивается с ростом температуры и , что приводит к возрастанию плотности. С другой стороны, при нагревании средняя длина водородных связей становится больше, в результате чего плотность уменьшается. Совместное действие двух факторов объясняет наличие максимума плотности воды при 3,98 °С.
Химические свойства. Лишь незначительная доля (при 25°С - примерно 1 на 5*10 9) подвергается электролитической по схеме: Н 2 О Н + + ОН - . Н + в водной среде, взаимодействуя с , образует Н 3 О + , объединяющийся с 1 Н 2 О в H 5 O 2 + . Расстояние О...О в таких комплексах заметно короче длины нормальной водородной связи между нейтральными . Но поскольку , по-видимому, находится не точно посредине этой укороченной связи, а ближе к одному из О, можно считать, что в существует гидратированный оксония Н 3 О + . Это явление играет большую роль в хим. процессах, происходящих в различных системах, в том числе биологических. В частности, - причина слабых кислот и (или) оснований. Н + и связанная с ней ОН - -важные характеристики водных растворов (см. Водородный показатель). Степень электролитической заметно возрастает при повышении температуры.
Питьевая . Общее число микроорганизмов в 1 мл питьевой должно быть не выше 100, число бактерий группы кишечных палочек (коли-индекс) - не более 3.




