Самые известные химические явления. Химия вокруг нас Химия и химические явления окружают нас повсюду. Приготовление пищи это тоже химические процессы. В повседневной жизни, сам того не подозревая, - презентация
Катасонов Никита, Савостьянова Евгения, Задорина Елизавета, Дмитриев Илья, Ермаков Павел
Исследовательский проект "Химические реакции в повседневной жизни" подготовлен группой учащихся 8-9 классов для школьной конференции исследовательских работ . Цели и задачи:
1. Выявление наиболее используемых в быту химических реакций.
2. Анализ литературы для установления сути реакций.
3. Опредилить степень безопасности (опасности) продуктов реакций для человека.
Скачать:
Предварительный просмотр:
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
Химические реакции в нашей повседневной жизни Участники проекта: 1.Савостьянова Евгения Константиновна 9класс 2.Задорина Елизавета Вадимовна 8 класс 3.Ермаков Павел Игоревич 9 класс 4.Дмитриев Илья Алексеевич 9 класс 5. Катасонов Никита Сергеевич 9 класс Руководитель: Лазарева Елена Александровна 2014 год Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа № 17»
Актуальность выбранной темы В наше время, известны миллионы различных веществ. Многие из них используются не только в промышленности и сельском хозяйстве, но и в быту. К сожалению, не все люди владеют элементарными химическими знаниями о веществах и их превращениях. Мы считаем, что ещё со школьной скамьи необходимо прививать химическую грамотность. Поэтому тема «Химические реакции в нашей повседневной жизни» будет актуальна.
Цели и задачи: 1. Выявление наиболее используемых в быту химических реакций. 2. Анализ литературы для установления сути реакций. 3. Опредилить степень безопасности (опасности) продуктов реакций для человека.
Горение природного газа Россия является лидером по запасам и добыче природного газа. Поэтому в наших домах мы используем реакцию горения природного газа для получения тепловой энергии. Природный газ - смесь газов, образовавшихся в недрах Земли при анаэробном разложении органических веществ. Химический состав: этан (C 2 H 6),пропан (C 3 H 8)бутан (C 4 H 10). А также другие не углеводородные вещества: водород (H 2), сероводород (H 2 S), диоксид углерода (СО 2), азот (N 2), гелий (Не). Основную часть природного газа составляет метан (CH 4) - от 92 до 98 %. Это бесцветный, лёгкий, горючий газ, не имеющий запаха, почти не растворим в воде. Смесь метана в воздухе взрывоопасна. Реакция горения метана CH 4 + 2O 2 = CO 2 + 2H 2 O + Q. Метан горит синеватым или почти бесцветным пламенем, выделяя большое количество теплоты (879 кДж/моль). При использовании газового оборудования в доме необходимо: проверять дымоход, проветривать помещение, следить за состоянием газовых трубопроводов, не оставлять работающее газовое оборудование без внимания.
Горение спички При большом выборе разнообразных зажигалок, спички пользуются высокой популярностью. Какие процессы происходят во время поджигания спички? Вот ею чиркнули о коробок. Появилось пламя и резкий запах «серы». Процесс начался под действием трения. Сначала загорелся красный фосфор, который был на спичечной коробке 4Р+5О 2 =2Р 2 О 5 Фосфор, дающий при трении высокую температуру, поджег смесь серы и бертолетовой соли в спичечной головке S+O 2 =SO 2 (SO 2 - сернистый газ, источник резкого запаха). Головка подожгла древесину С 6 Н 10 О 5 +6О 2 =6СО 2 +5Н 2 О Почти все продукты горения вредны для организма. Только при горении одной спички их выделяется ничтожное количество, что не оказывает существенного воздействия на человека. Но при использовании спичек химически образованный человек должен помнить, что «CПИЧКИ – ЭТО НЕ УГРУШКА!»
Гидролиз мыла В производстве и быту мылом называют технические смеси водорастворимых солей высших жирных кислот часто с добавками некоторых других веществ, обладающим моющим действием. Основу смесей обычно составляют натриевые (реже калиевые и аммониевые) соли насыщенных и ненасыщенных жирных кислот с числом атомов углерода в молекуле от 12 до 18 (стеариновой, пальмитиновой, миристиновой, лауриновой и олеиновой). К мылам часто относят также соли нафтеновых и смоляных кислот, а иногда и другие соединения, обладающие в растворах моющей способностью. Мыла образованы сильным основанием и слабой кислотой, поэтому легко подвергаются гидролизу: С 17 Н 35 СООNa + Н 2 О = С 17 Н 35 СООН + NaОН Среда при гидролизе щелочная, поэтому мыла достаточно агрессивны по отношению к коже и частое их применение приводят к обезжириванию. Сортов и марок мыла существует великое множество, и прежде чем выбрать самое подходящее, надо определить тип своей кожи. Жирная кожа часто блестит из-за сильного пота и жиро отделения, на ней обычно крупные поры. Уже через 2 часа после умывания на приложенной к лицу салфетке жирная кожа оставляет пятна. Для такой кожи требуется мыло с легким осушающим действием. Сухая кожа тонкая и очень чувствительная к ветру и непогоде, а поры на ней мелкие и тонкие; она легко трескается, так как недостаточно эластична. Такой коже надо создавать максимальный комфорт и щадящий режим, лучше использовать дорогие сорта мыла. Нормальная кожа мягкая, гладкая, имеет поры среднего размера.
Пероксид водорода Пероксид водорода - простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Эго часто используют в быту в качестве отбеливателя и антисептика. При разложении пероксида водорода (когда мы обрабатываем рану) выделяется вода и газообразный кислород. 2Н 2 О 2 =О 2 +2Н 2 О При не больших дозах соответственно выделяется небольшое количество кислорода. В малом объёме чистый кислород не опасен, а при большом объёме? А при большом количестве чистый кислород токсичен и может вызвать легочную форму кислородного отравления и вредное действие на центральную нервную систему. Первое воздействие сопровождается такими симптомами: раздражение легочной ткани. Оно может начаться с легкого раздражения глотки и последующего кашля. В тяжелых случаях может отмечаться продолжительное жжение в груди и неконтролируемый кашель. Легочная форма кислородного отравления также может вызывать уменьшение жизненной емкости легких и снижение способности к газообмену, хотя эти осложнения встречаются крайне редко. А симптомы второго воздействия (токсического поражения ЦНС) включают: нарушения зрения (туннельное зрение, неспособность сфокусироваться), нарушение слуха (звон в ушах, появление посторонних звуков), тошноту, судорожные сокращения (особенно мышц лица), повышенную чувствительность к внешним раздражителям и головокружение. Но все это возможно только при использовании больших объемов пероксида водорода, а обычная 3% перекись неспособна на такое.
Гашение соды уксусом Процесс гашения соды уксусом используется при замесе теста для булочек и блинов. Пищевая сода при воздействии на нее высокой температуры или кислой среды дает усиленную реакцию по выделению углекислого газа, что в свою очередь приводит к пышности и пористости. CH 3 COOH+NaHCO 3 =CH 3 COONa + H 2 O+CO 2 Вопрос «гасить или не гасить соду уксусом при выпечке» настолько же вечен, как и вопрос: «что было раньше – курица или яйцо». Однако, покопавшись в литературе, перерыв кучу сайтов, в том числе и зарубежных, пришла к выводу, что вопросу этому от силы лет 70-80. Перерыв великое множество рецептов старинной русской кухни не нашла ни одного, где упоминалась бы сода. Выпечка раньше в нашей стране была преимущественно дрожжевая, либо без добавления вообще каких-либо ускорителей подъема и разрыхления. Итак, пищевая сода была изобретена французским химиком Лебланком в конце XVIII столетия. До России это изобретение дошло значительно позже, после получения нового способа ее изготовления. Как только у русских хозяек появился такой продукт, как сода, они стали применять и использовать ее в кулинарии. Почему соду был решено гасить? Да просто потому, что наша традиция есть все «с пылу, с жару» в данном случае – только вредна. Негашеная сода в горячей выпечке имеет очень неприятный «мыльный» вкус. Что «исправлялось» ее гашением, а именно, добавлением в соду кипятка либо, кисломолочных продуктов. Для блинов данный способ и сейчас дает очень неплохие результаты. Однако, можно представить себе, что произойдет с песочным тестом, если туда влить стакан кипятка? Ответ очевиден. Поэтому и было придумано заменять кипяток или кисломолочные продукты разведенным 9% уксусом или лимонным соком.
Вывод Многие химические реакции мы можем наблюдать не только на уроках химии, но и в быту. Эти реакции не только безопасны (при соблюдении правил безопасности) , но и некоторые из них бесполезны. Например: гашение соды уксусом,любой умелый повар сказал бы, что это пустая трата времени. Но без таких реакций как гидролиз и горение мы просто не имеем представления о дальнейшем существовании. Во время протекания этих химических реакций выделяются газы. Они безопасны (в определённом количестве). При использовании химических веществ в быту необходимы соблюдение правил техники безопасности.
Источники информации 1. Крицман, В.А., Станцо, В.В. Энциклопедический словарь юного химика [ Текст ]- М. : Педагогика, 1990. 2. Лаврова, С.А. Занимательная химия [ Текст ] -М. : Белый город, 2009. 3. Рюмин, В. Занимательная Химия [ Текст ]- М.: Центрполиграф,2012. 4. Курдюмов, Г.М. 1234 вопроса по Химии [ Текст ]- М. : Мир, Бином, 2007. 5. Гузей, Л.С., Кузнецов, В.Н. Новый справочник по химии [ Текст ] -М. : Большая медведица, 1999 6. Википедия [Электронный ресурс] - Режим доступа: ru.wikipedia.org 7. Егорова, А.С. Репетитор по химии [ Текст ]-М. : Феникс, 2007 8. Химия и Жизнь [ Электронный ресурс] - Режим доступа: http: //www.hij.ru 9 . Химия вокруг нас [ Электронный ресурс] - Режим доступа: http://interestingchem.narod.ru/chemaround.htm
К ним относятся те, что можно наблюдать в повседневной жизни современного человека. Некоторые из них совсем простые и очевидные, любой может наблюдать их на своей кухне, как пример с завариванием чая.
На примере крепкой (концентрированной) чайной заварки можете самостоятельно провести и еще один опыт: осветлить чай при помощи дольки лимона. Из-за кислот, содержащихся в лимонном соке, жидкость еще раз изменит свой состав.
Какие еще явления вы можете наблюдать в быту? Например, к химическим явлениям относится процесс сгорания топлива в двигателе.
Если упростить, реакцию сгорания топлива в двигателе можно описать так: кислород + топливо = вода + углекислый газ.
Вообще в камере двигателя внутреннего сгорания происходит несколько реакций, в которых задействованы топливо (углеводороды), воздух и искра зажигания. А точнее, не просто топливо - топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается.
Сгорание смеси происходит в доли секунды, в итоге связь между атомами водорода и углерода разрушается. Благодаря этому высвобождается большое количество энергии, которая приводит в движение поршень, а тот - коленчатый вал.
В дальнейшем атомы водорода и углерода соединяются с атомами кислорода, образуется вода и углекислый газ.
В идеале реакция полного сгорания топлива должна выглядеть так: CnH2n+2 + (1,5n+0,5)O2 = nCO2 + (n+1)H2O. В реальности же двигатели внутреннего сгорания не настолько эффективны. Предположим, если кислорода при реакции не хватает незначительно, в результате реакции образуется СО. А при большей нехватке кислорода образуется сажа (С).
Образование налета на металлах в результате окисления (ржавчина на железе, патина на меди, потемнение серебра) - тоже из категории бытовых химических явлений.
Возьмем железо для примера. Ржавление (окисление) происходит под воздействием влаги (влажность воздуха, прямой контакт с водой). Результатом этого процесса становится гидроксид железа Fe2O3 (точнее, Fe2O3 * H2O). Вы можете увидеть его в виде рыхлого, шероховатого, оранжевого или красно- коричневого налета на поверхности металлических изделий.
Другим примером может послужить зеленый налет (патина) на поверхности изделий из меди и бронзы. Он образуется со временем под воздействием атмосферного кислорода и влажности: 2Cu + O2 + H2O + CO2 = Cu2CO5H2 (или CuCO3 * Cu(OH)2). Полученный в итоге основной карбонат меди встречается и в природе - в виде минерала малахита.
И еще один пример медленной окислительной реакции металла в бытовых условиях - это образование темного налета сульфида серебра Ag2S на поверхности серебряных изделий: украшений, столовых приборов и т.п.
«Ответственность» за его возникновение несут частички серы, которые в виде сероводорода присутствуют в воздухе, которым мы с вами дышим. Потемнеть серебро может и при контакте с серосодержащими пищевыми продуктами (яйцами, например). Реакция же выглядит так: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
Вернемся на кухню. Здесь можно рассмотреть еще несколько любопытных химических явлений: образование накипи в чайнике одно из них.
В бытовых условиях нет химически чистой воды, в ней всегда в различной концентрации растворены соли металлов и другие вещества. Если вода насыщена солями кальция и магния (гидрокарбонатами), ее называют жесткой. Чем выше концентрация солей, тем более жесткой является вода.
Когда такая вода нагревается, эти соли подвергаются разложению на углекислый газ и нерастворимый осадок (СаСО3 иMgСО3). Эти твердые отложения вы и можете наблюдать, заглянув в чайник (а также взглянув на нагревательные элементы стиральных и посудомоечных машинок, утюгов).
Кроме кальция и магния (из которых получается карбонатная накипь), в воде также часто присутствует железо. В ходе химических реакций гидролиза и окисления из него образуются гидроксиды.
Кстати, собравшись избавиться от накипи в чайнике, вы можете наблюдать еще один пример занимательной химии в быту: с отложениями хорошо справляются обычный столовый уксус и лимонная кислота. Чайник с раствором уксуса/лимонной кислоты и воды кипятят, после чего накипь исчезает.
А без другого химического явления не было бы вкусных маминых пирогов и булочек: речь о гашении соды уксусом.
Когда мама гасит соду в ложке уксусом, происходит вот такая реакция: NaHCO3 + CH3COOH = CH3COONa + H2O + CO2. Полученный в ее результате углекислый газ стремится покинуть тесто - и тем самым изменяет его структуру, делает пористым и рыхлым.
Кстати, можете рассказать маме, что гасить соду вовсе не обязательно - она и так прореагирует, когда тесто попадет в духовку. Реакция, правда, будет проходить немного хуже, чем при гашении соды. Но при температуре от 60 градусов (а лучше 200) происходит разложение соды на карбонат натрия, воду и все тот же углекислый газ. Правда, вкус готовых пирогов и булочек может оказаться хуже.
Список бытовых химических явлений не менее впечатляющий, чем список таких явлений в природе. Благодаря им у нас есть дороги (изготовление асфальта - это химические явление), дома (обжиг кирпича), красивые ткани для одежды (окрашивание). Если задуматься об этом, становится отчетливо ясно, насколько многогранная и интересная наука химия. И сколько пользы можно извлечь из понимания ее законов.
Часть I
1. Изменения, происходящие с телами и веществами, - это
2. Отношение людей к химии.
3. Артефакт алхимии – философский камень.
Он (укажите роль):
1) смешивание эликсиров
2) целительство, врачевание
4. Заполните таблицу «Великие русские химики».

Часть II
1. Выберите синонимы понятия «химические явления».
2) химические реакции
3) явления, при которых из одних веществ образуются другие вещества
4) явления, при которых изменяется цвет вещества, образуется осадок или газ
2. Разделите явления на физические (А) и химические (Б).
3. Проанализируйте рисунки и назовите процесс.

а) горение – химическое явление
б) подача мяча – физическое явление
в) растворение – физическое явление
г) гашение соды – химическое явление
д) горение - химическое явление
е) притягивание магнитом - физическое явление
Установите соответствие между физическим или химическим явлением и процессом, изображённым на рисунке.
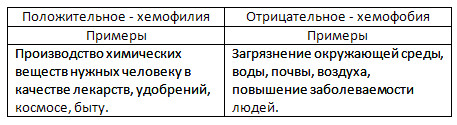
4. Сделайте презентацию на одну из предложенных тем: «Отрицательное значение химии» или «Положительное значение химии», используя возможности Интернета.
5. Вычеркните «лишнее»:
Замерзание воды, испарение воды, кипение воды, разложение воды на водород и кислород
, фильтрование воды.
6. Заполните таблицу «Физические и химические явления», используя результаты своих наблюдений за процессами в быту и в природе.

7. С помощью Интернета и других источников информации (научная литература) сделайте сообщение о жизни и творчестве одного из трёх великих русских химиков по следующему плану:
1) детство;
2) учёба в юношеские годы;
3) научная деятельность, основные научные достижения.
Д. И. Менделеев – родился в семье директора попечителя училищ, был 14 и самым любимым ребёнком в семье. Воспитывала его мать, так как отец вскоре после его рождения ослеп и умер. Менделеев в гимназии не отличался особым прилежанием, особенно не любил закон Божий. Он хотел поступить в медицинскую академию, но биология оказалась ему не под силу, и пошёл в педагогику.
Учился он хорошо, но сильно заболел, и посоветовали лекари ему поехать на юг. Вылечился, блестяще защитился и начал исследовательские работы.
1. Исследовал явление изоморфизма.
2. Сконструировал пикнометр – прибор для определения плотности жидкостей.
3. Открыл температуру кипения жидкостей, их критическую температуру.
4. Издал первый учебник по органической химии в России.
5. Создал гидратную теорию растворов.
6. Открыл периодическую систему химических элементов, сформулировал Периодический закон.
7. На основе закона и таблицы предсказал существование нескольких химических элементов.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Запорожская общеобразовательная школа І-ІІІ ступеней № 90
Химические явления в повседневной жизни и быту
Ученик 7-А класса
Дмитрий Балуев
Введение
химический реакция топливо окисление
Окружающий нас мир, при всём его богатстве и многообразии, живёт по законам, которые достаточно легко объяснить с помощью таких наук, как физика и химия. И даже в основе жизнедеятельности такого сложного организма, как человек, лежит не что иное, как химические явления и процессы.
Наверняка, вы не раз замечали что-нибудь вроде того, как мамино серебряное кольцо со временем темнеет. Или как ржавеет гвоздь. Или как сгорают до золы деревянные поленья. Но даже если ваша мама не любит серебро, а в походы вы никогда не ходили, уж как заваривается чайный пакетик в чашке видели точно.
Что общего у всех этих примеров? А то, что все они относятся к химическим явлениям.
Итак, самые распространение примеры химических явлений в жизни и быту:
ржавление гвоздя
сгорание топлива
выпадение осадка
брожение виноградного сока
гниение бумаги
синтез духов
потемнение серебряной сережки
появление зеленого налета на бронзе
образование накипи в котлах
гашение соды уксусом
протухание мяса
горение бумаги
Хотите подробностей? Элементарный пример - чайник, поставленный на огонь. Через некоторое время вода начнёт нагреваться, затем закипать. Мы услышим характерное шипение, из горлышка чайника будут вылетать струйки пара. Откуда он взялся, ведь в посуде его изначально не было! Да, но вода, при определённой температуре, начинает превращаться в газ, меняет своё физическое состояние из жидкого на газообразное. Т.е. она осталась всё той же водой, только теперь в виде пара. Это физическое явление.
А химические явления мы увидим, если опустим в кипяток пакетик с чайной заваркой. Вода в стакане или другом сосуде окрасится в красно-коричневый цвет. Произойдёт химическая реакция: под воздействием тепла чаинки начнут запариваться, выделяя цветовые пигменты и вкусовые свойства, присущие этому растению. У нас получится новое вещество - напиток со специфическими, свойственными только ему качественными характеристиками. Если туда же добавим несколько ложек сахара, он растворится (физическая реакция), а чай станет сладким (реакция химическая). Таким образом, физические и химические явления часто связаны и взаимозависимы. К примеру, если тот же чайный пакетик поместить в холодную воду, реакции не произойдёт, чаинки и вода не будут взаимодействовать, да и сахар растворяться тоже не пожелает.
Таким образом, химические явления - это такие, при которых одни вещества превращаются в другие (вода в чай, вода в сироп, дрова в золу и т.д.) Иначе химическое явление называется химической реакцией.
О том, происходят ли химические явления, мы можем судить по некоторым признакам и изменениям, которые наблюдаются у того или иного тела или вещества. Так, большинство химических реакций сопровождается следующими «опознавательными знаками»:
в результате или при протекании таковой выпадает осадок;
происходит изменение цвета вещества;
может выделяться газ, например, угарный при горении;
происходит поглощение или, наоборот, выделение теплоты;
возможно излучение света.
Чтобы химические явления наблюдались, т.е. реакции происходили, необходимы некоторые условия:
реагирующие вещества должны соприкасаться, быть друг с другом в контакте (т.е. ту же заварку нужно насыпать в кружку с кипятком);
вещества лучше измельчать, тогда реакция будет протекать быстрее, скорее наступит взаимодействие (сахар-песок скорее растворится, растает в горячей воде, чем кусковой);
чтобы многие реакции могли произойти, нужно изменить температурный режим реагирующих компонентов, охлаждая или нагревая их до некоторой температуры.
Понаблюдать за химическим явлением можно опытным путём. А вот описать его на бумаге можно при помощи химического уравнения (уравнения химической реакции).
Некоторые из этих условий работают и для возникновения физических явлений, например, изменение температуры или непосредственный контакт предметов, тел между собой. Допустим, если ударить достаточно сильно молотком по шляпке гвоздя, он может деформироваться, потерять свою обычную форму. Но она так и останется шляпкой гвоздя. Или же, при включении электролампы в сеть, вольфрамовая нить внутри неё начнёт греться и светиться. Однако вещество, из которого нить сделана, так и останется прежним вольфрамом.
Но давайте разберем еще несколько примеров. Ведь все мы понимаем, что химия происходит не только в пробирках в школьной лаборатории.
1. Химические явления в быту
К ним относятся те, что можно наблюдать в повседневной жизни современного человека. Некоторые из них совсем простые и очевидные, любой может наблюдать их на своей кухне, как пример с завариванием чая.
На примере крепкой (концентрированной) чайной заварки можете самостоятельно провести и еще один опыт: осветлить чай при помощи дольки лимона. Из-за кислот, содержащихся в лимонном соке, жидкость еще раз изменит свой состав.
Какие еще явления вы можете наблюдать в быту? Например, к химическим явлениям относится процесс сгорания топлива в двигателе.
Если упростить, реакцию сгорания топлива в двигателе можно описать так: кислород + топливо = вода + углекислый газ.
Вообще в камере двигателя внутреннего сгорания происходит несколько реакций, в которых задействованы топливо (углеводороды), воздух и искра зажигания. А точнее, не просто топливо - топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается.
Сгорание смеси происходит в доли секунды, в итоге связь между атомами водорода и углерода разрушается. Благодаря этому высвобождается большое количество энергии, которая приводит в движение поршень, а тот - коленчатый вал.
В дальнейшем атомы водорода и углерода соединяются с атомами кислорода, образуется вода и углекислый газ.
В идеале реакция полного сгорания топлива должна выглядеть так: CnH2n+2 + (1,5n+0,5)O2 = nCO2 + (n+1)H2O. В реальности же двигатели внутреннего сгорания не настолько эффективны. Предположим, если кислорода при реакции не хватает незначительно, в результате реакции образуется СО. А при большей нехватке кислорода образуется сажа (С).
Образование налета на металлах в результате окисления (ржавчина на железе, патина на меди, потемнение серебра) - тоже из категории бытовых химических явлений.
Возьмем железо для примера. Ржавление (окисление) происходит под воздействием влаги (влажность воздуха, прямой контакт с водой). Результатом этого процесса становится гидроксид железа Fe2O3 (точнее, Fe2O3 * H2O). Вы можете увидеть его в виде рыхлого, шероховатого, оранжевого или красно- коричневого налета на поверхности металлических изделий.
Другим примером может послужить зеленый налет (патина) на поверхности изделий из меди и бронзы. Он образуется со временем под воздействием атмосферного кислорода и влажности: 2Cu + O2 + H2O + CO2 = Cu2CO5H2 (или CuCO3 * Cu(OH)2). Полученный в итоге основной карбонат меди встречается и в природе - в виде минерала малахита.
И еще один пример медленной окислительной реакции металла в бытовых условиях - это образование темного налета сульфида серебра Ag2S на поверхности серебряных изделий: украшений, столовых приборов и т.п.
«Ответственность» за его возникновение несут частички серы, которые в виде сероводорода присутствуют в воздухе, которым мы с вами дышим. Потемнеть серебро может и при контакте с серосодержащими пищевыми продуктами (яйцами, например). Реакция же выглядит так: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
Вернемся на кухню. Здесь можно рассмотреть еще несколько любопытных химических явлений: образование накипи в чайнике одно из них.
В бытовых условиях нет химически чистой воды, в ней всегда в различной концентрации растворены соли металлов и другие вещества. Если вода насыщена солями кальция и магния (гидрокарбонатами), ее называют жесткой. Чем выше концентрация солей, тем более жесткой является вода.
Когда такая вода нагревается, эти соли подвергаются разложению на углекислый газ и нерастворимый осадок (СаСО3 иMgСО3). Эти твердые отложения вы и можете наблюдать, заглянув в чайник (а также взглянув на нагревательные элементы стиральных и посудомоечных машинок, утюгов).
Кроме кальция и магния (из которых получается карбонатная накипь), в воде также часто присутствует железо. В ходе химических реакций гидролиза и окисления из него образуются гидроксиды.
Кстати, собравшись избавиться от накипи в чайнике, вы можете наблюдать еще один пример занимательной химии в быту: с отложениями хорошо справляются обычный столовый уксус и лимонная кислота. Чайник с раствором уксуса/лимонной кислоты и воды кипятят, после чего накипь исчезает.
А без другого химического явления не было бы вкусных маминых пирогов и булочек: речь о гашении соды уксусом.
Когда мама гасит соду в ложке уксусом, происходит вот такая реакция: NaHCO3 + CH3COOH = CH3COONa + H2O + CO2. Полученный в ее результате углекислый газ стремится покинуть тесто - и тем самым изменяет его структуру, делает пористым и рыхлым.
Кстати, можете рассказать маме, что гасить соду вовсе не обязательно - она и так прореагирует, когда тесто попадет в духовку. Реакция, правда, будет проходить немного хуже, чем при гашении соды. Но при температуре от 60 градусов (а лучше 200) происходит разложение соды на карбонат натрия, воду и все тот же углекислый газ. Правда, вкус готовых пирогов и булочек может оказаться хуже.
Список бытовых химических явлений не менее впечатляющий, чем список таких явлений в природе. Благодаря им у нас есть дороги (изготовление асфальта - это химические явление), дома (обжиг кирпича), красивые ткани для одежды (окрашивание). Если задуматься об этом, становится отчетливо ясно, насколько многогранная и интересная наука химия. И сколько пользы можно извлечь из понимания ее законов.
2. Интересные химические явления
Хотелось бы добавить немного интересностей. Среди многих и многих придуманных природой и человеком явлений есть особенные, которые сложно описать и объяснить. К ним относится и горение воды. Как такое, может быть, спросите вы, ведь вода не горит, ею тушат огонь? Как она может гореть? А дело вот в чем.
Горение воды - это химическое явление, при котором в воде с примесью солей под воздействием радиоволн разрываются кислородно-водородные связи. В результате образуется кислород и водород. И горит, конечно, не сама вода, а именно водород.
При этом он достигает очень высокой температуры горения (больше полутора тысяч градусов), плюс в ходе реакции снова образуется вода.
Это явление давно интересует ученых, мечтающих научиться использовать воду в качестве топлива. Например, для автомобилей. Пока это нечто из области фантастики, но кто знает, что ученые сумеют изобрести совсем скоро. Одна из главных загвоздок в том, чтобы при горении воды энергии выделялось больше, чем затрачивается на проведение реакции.
Кстати, нечто подобное можно наблюдать и в природе. Согласно одной из теорий, большие волны-одиночки, появляющиеся словно бы из ниоткуда, на самом деле являются следствием водородного взрыва. Электролиз воды, который к нему приводит, осуществляется благодаря попаданию электрических разрядов (молний) на поверхность соленой воды морей и океанов.
Но не только в воде, но и на суше можно наблюдать поражающие воображение химические явления. Если бы вам довелось побывать в природной пещере, наверняка вы смогли бы увидеть там причудливые, красивые природные «сосульки», свисающие с потолка - сталактиты. То, как и почему они появляются, объясняется еще одним интересным химическим явлением.
Химик, глядя на сталактит, видит, конечно, не сосульку, а карбонат кальция СаСО3. Основой для его образования служат сточные воды, природный известняк, а сам сталактит выстраивается благодаря осаждению карбоната кальция (рост вниз) и силе сцепления атомов в кристаллической решетке (рост вширь).
К слову, аналогичные образования могут подниматься от пола к потолку - их называют сталагмиты. А если сталактиты и сталагмиты встречаются и срастаются в цельные колонны, они получают название сталагнаты.
Заключение
В мире ежедневно происходит множество удивительных, прекрасных, а также опасных и пугающих химических явлений. Из многих человек научился извлекать пользу: создает строительные материалы, готовит пищу, заставляет транспорт перемещаться на огромные расстояния и многое другое.
Без многих химических явлений не было бы возможным существование жизни на земле: без озонового слоя люди, животные, растения не выжили бы из-за ультрафиолетовых лучей. Без фотосинтеза растений животным и людям нечем было бы дышать, а без химических реакций дыхания этот вопрос вообще не был бы актуальным.
Брожение позволяет готовить продукты питания, а сходное с ним химическое явление гниения разлагает белки на более простые соединения и возвращает те в круговорот веществ в природе.
Образование оксида при нагревании меди, сопровождающееся ярким свечением горение магния, плавление сахара и др. тоже считают химическими явлениями. И находят им полезное применение.
Размещено на Allbest.ru
...Подобные документы
Проблема гибели людей при пожарах – предмет особого беспокойства. Определение пожарной безопасности, основные функции системы ее обеспечения. Причины и источники пожаров на производстве. Пожарная безопасность в быту. Мероприятия по пожарной профилактике.
реферат , добавлен 16.02.2009
Причины пожаров в быту и основные правила пожарной безопасности. Правила обращения с газом и газовыми приборами. Курение в постели - одна из основных причин пожаров в квартирах. Меры тушения пожара, эвакуации людей и имущества до прибытия пожарной части.
реферат , добавлен 24.01.2011
Сущность психической, физической и социальной безопасности ребенка. Правила безопасного поведения детей в быту, дорожного движения пешехода и пассажира транспортного средства. Методы формирования осторожного отношения к потенциально опасным ситуациям.
курсовая работа , добавлен 24.10.2014
Понятие социально-опасных явлений и причины их возникновения. Бедность как результат снижения уровня жизни. Голод как следствие нехватки продовольствия. Криминализация общества и социальная катастрофа. Способы защиты от социально-опасных явлений.
контрольная работа , добавлен 05.02.2013
Рассмотрение особенностей развития пожаров, начинающихся со стадии тлеющего горения. Основные признаки возникновения огня от маломощного источника зажигания. Изучение версии о возникновении пожара в результате протекания процессов самовозгорания.
презентация , добавлен 26.09.2014
Электротравматизм на производстве и в быту. Воздействие электрического тока на организм человека. Электротравма. Условия поражения электрическим током. Технические способы и средства электробезопасности. Оптимизация защиты в распределительных сетях.
реферат , добавлен 04.01.2009
Причины и возможные последствия пожаров. Основные поражающие факторы: горение, возгорание, воспламенение. Методы тушения пожаров. Классификация средств и характеристика огнегасительных веществ. Основные меры пожарной безопасности в быту и первая помощь.
реферат , добавлен 04.04.2009
Определение понятия и видов опасных гидрологических явлений. Ознакомление с историей самых страшных наводнений. Описание разрушительного действия цунами. Причины и последствия лимнологической катастрофы. Механизм образования и мощность потоков сели.
презентация , добавлен 22.10.2015
Причины возникновения, степени и основные признаки химических ожогов. Особенности химических ожогов глаз, пищевода и желудка. Правила работы с кислотами и щелочами. Первая помощь при получении химического ожога. Меры предупреждения химических ожогов.
контрольная работа , добавлен 14.05.2015
Виды бытовых происшествий со смертельным исходом, причины их возникновения. Отравление чистящими и моющими средствами, первая помощь. Предупреждение пищевого отравления. Утечка газа в квартире. Едкие вещества, кипящие жидкости. Меры предупреждения ожогов.




