Химические реакции белков с уравнениями. Цветные реакции белков
Раздел 1. Строение, свойства и функции белков
Тема 1.1. Строение и классификация аминокислот. Структура белков 6
Тема 1.2. Структура и физико-химические свойства белков 11
Тема 1.3. Классификация белков. Строение и функции белков в организме. Сложные белки 16
Тестовые задания 19
Ситуационные задачи 21
Раздел 2. Строение, классификация и роль витаминов
Тема 2.1. Жирорастворимые витамины 22
Тема 2.2. Водорастворимые витамины 27
Тестовые задания 34
Ситуационные задачи 35
Раздел 3. Энзимология
Тема 3.1. Строение и свойства ферментов. Регуляция активности ферментов 36
Тема 3.2. Классификация и номенклатура ферментов. Использование ферментов в медицине 45
Тестовые задания 48
Ситуационные задачи 49
Раздел 4. Биологическое окисление
Тема 4.1. Общие пути катаболизма: окислительное декарбоксилирование пирувата. Цикл трикарбоновых кислот. Ферменты дыхательной цепи. Окислительное фосфорилирование (семинар) 54
Тестовые задания 56
Ситуационные задачи 57
Раздел 5. Обмен аминокислот и белков
Тема 5.1. Внешний обмен белков 58
Тема 5.2. Внутриклеточный обмен аминокислот 67
Тема 5.3. Пути превращения аммиака и его обезвреживание 71
Тема 5.4. Особенности и нарушения обмена некоторых аминокислот 76
Тестовые задания 82
Ситуационные задачи 83
Раздел 6. Строение и обмен пуриновых и пиримидиновых нуклеотидов
Тема 6.1. Строение и метаболизм пуриновых и пиримидиновых нуклеотидов 84
Тестовые задания 90
Ситуационные задачи 91
Раздел 7. Матричные биосинтезы
Тема 7.1. Синтез нуклеиновых кислот и его регуляция 92
Тема 7.2. Биосинтез белка и его регуляция 95
Тестовые задания 102
Ситуационные задачи 104
Контрольные вопросы к итоговому занятию
Раздел 8. Строение и обмен углеводов
Тема 8.1. Строение и внешний обмен углеводов. Обмен гликогена 109
Тема 8.2. Окисление глюкозы в анаэробных условиях. Глюконеогенез 115
Тема 8.3. Аэробное окисление глюкозы. Пентозофосфатный путь 122
Тестовые задания 128
Ситуационные задачи 129
Контрольные вопросы к итоговому занятию
Раздел 9. Строение и обмен липидов
Тема 9.1. Строение и внешний обмен липидов 134
Тема 9.2. Внутриклеточный обмен жирных кислот и триацилглицеролов 140
Тема 9.3. Внутриклеточный обмен фосфолипидов и холестерола. Транспорт липидов в крови 147
Тестовые задания 150
Ситуационные задачи 152
Контрольные вопросы к итоговому занятию
Раздел 10. Гормональная регуляция обмена веществ и функций организма
Тема 10.1. Механизмы передачи гормонального сигнала. Классификация гормонов. Гормоны гипофиза. (семинар) 157
Тема 10.2. Гормоны гипоталамуса, гипофиза, щитовидной
поджелудочной и паращитовидной желез 159
Тема 10.3. Гормоны гипофиза, надпочечников и половых желез 164
Тестовые задания 168
Ситуационные задачи 169
Раздел 11. Биохимия крови
Тема 11.1. Азотсодержащие вещества крови: белки, ферменты, фракции остаточного азота 170
Тема 11.2. Обмен железа. Гемопротеины. Синтез и распад гема 182
Тема 11.3. Неорганические вещества крови. Кислотно-основное
состояние 190
Тестовые задания 201
Ситуационные задачи 202
Раздел 12. Биохимия почек и печени
Тема 12.1. Водно-солевой обмен. Нормальные и патологические компоненты мочи 204
Тема 12.2. Участие печени в метаболизме веществ. Биотрансформация ксенобиотиков 214
Тестовые задания 218
Ситуационные задачи 220
Контрольные вопросы к итоговому занятию
Приложение 1
Классификация и номенклатура ферментов 226
Приложение 2
Индивидуальные белки плазмы крови 240
Приложение 3
Нормальные величины изученных биохимических показателей 246
Приложение 4
Эталоны ответов к тестовым заданиям 250
Эталоны ответов к ситуационным задачам 252
Раздел 1.
Строение, свойства и функции белков
Тема 1.1.
Строение и классификация аминокислот.
Структура белков
Актуальность
Аминокислоты являются материалом для строительства белков – пластического материала клеток живого организма. Особенностями аминокислотного состава обусловлено огромное разнообразие структуры и функций белковых молекул, благодаря чему белкам принадлежит ведущая роль во всех процессах жизнедеятельности. Аминокислоты участвуют в образовании биогенных аминов, азотистых оснований и мононуклеотидов, нейромедиаторов и т.д. Ряд из них используются в качестве лекарств.
Цель
Знакомство со строением, физико-химическими свойствами и классификацией аминокислот, входящих в состав белков организма человека.
Приобретение практических навыков по проведению качественного анализа биологических жидкостей на присутствие аминокислот, пептидов и белков при помощи цветных реакций.
Вопросы для самоподготовки
Принципы классификации аминокислот.
Классы аминокислот:
o по биологической роли (заменимые и незаменимые);
o по физико-химическим свойствам (нейтральные, кислые, основные; гидрофобные, гидрофильные);
o по химическому строению (с алифатическими радикалами, с дополнительной функциональной группой, с ароматическим и гетероциклическим радикалом, иминокислоты);
o по растворимости в воде (неполярные, полярные незаряженные, полярные отрицательно и положительно заряженные).
Структурные формулы протеиногенных аминокислот.
Физико-химические свойства аминокислот, роль их функциональных групп.
Изоэлектрическая точка аминокислот и пептидов. От чего она зависит?
Влияние изменения рН на заряд аминокислот.
Пептидная связь, реакция образования. Свойства пептидной связи.
Влияние изменения рН на заряд и растворимость пептидов.
Цветные качественные реакции на аминокислоты и белки. Принцип методов. Практическое применение реакций.
Обнаружение белка и свободных аминокислот в биологическом материале. Ключевые моменты анализа. Как удалить белок из биологической жидкости? Как обнаружить наличие свободных аминокислот в жидкости?
Лабораторная работа 1
Цветные качественные реакции на белок и аминокислоты
Реактивы
1) 1% р-р яичного белка, 2) 0,5% р-р нингидрина, 3) 30% р-р NaOH, 4) 10% р-р NaOH, 5) 5% р-р Pb(CH 3 COO) 2 , 6) 5% р-р нитропруссида натрия, 7) конц. HNO 3 , 8) 5% р-р CuSO 4 .
Материал исследования
При изучении цветных реакций в качестве объекта исследования используют 1% водный раствор яичного белка, содержащего полный набор аминокислот.
Реакция на пептидную связь
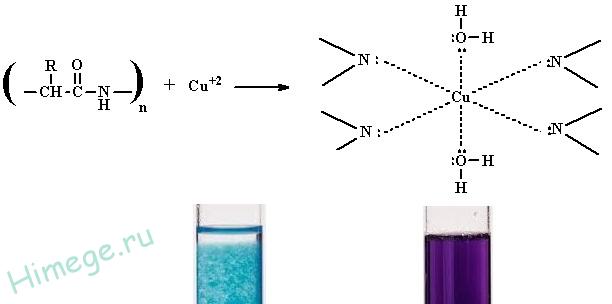
Для обнаружения пептидной связи в белках и пептидах используется универсальная биуретовая реакция . Биуретовую реакцию дают вещества, содержащие не менее двух пептидных группировок.
Принцип
Пептидная группа образует в щелочной среде с ионами Сu 2+ комплексное соединение фиолетового цвета с красным или синим оттенком в зависимости от числа пептидных связей. Интенсивность окрашивания пропорциональна количеству пептидных групп.
Проведение анализа
В пробирку с 5 каплями 1% раствора белка вносят 3 капли 10% раствора NаОН и 1 каплю 5% раствора CuSО 4 .
Реакция для обнаружения a‑аминогрупп
Для обнаружения a‑аминогрупп, содержащихся в аминокислотах, и концевых a‑аминогрупп пептидов и белков используется нингидриновая реакция .
Принцип
При нагревании аминокислот и пептидов с нингидрином происходят окислительное отщепление a‑аминогрупп и восстановление нингидрина. Восстановленный нингидрин реагирует с аммиаком и другой молекулой окисленного нингидрина с образованием комплекса сине-фиолетового цвета.
Проведение анализа
5 капель раствора белка смешивают с 5 каплями 0,5% раствора нингидрина. Пробирки нагревают и кипятят до появления сине-фиолетового окрашивания.
Реакция на ароматические аминокислоты
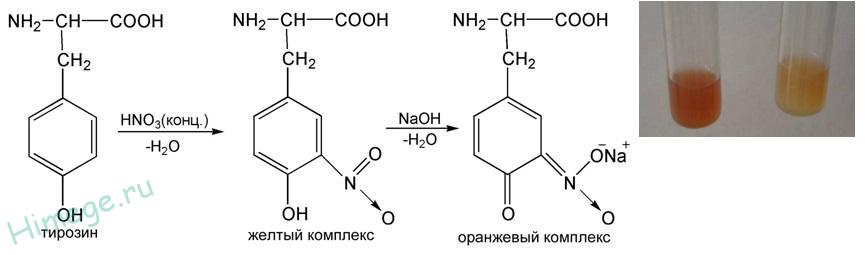
Для обнаружения ароматических аминокислот (фенилаланин, тирозин, триптофан) используется ксантопротеиновая реакция .
Принцип
Ароматическое кольцо при взаимодействии с концентрированной азотной кислотой образует динитросоединение желтого цвета.
Проведение анализа
К 5 каплям 1% раствора белка добавляют 2 капли конц.HNO 3 и осторожно нагревают. Наблюдают за появлением желтого окрашивания, при отсутствии желтого цвета еще добавляют 1-2 капли конц.HNO 3 . При добавлении избытка 30% раствора NаОН окраска переходит в оранжевую.
Реакции на серосодержащие аминокислоты
Принцип
Сульфгидрильные группы в белке или пептиде подвергаются щелочному гидролизу, в результате чего происходит отщепление серы в виде сульфида натрия Na 2 S, который вступает в дальнейшие реакции:
o реакция Фоля – Na 2 S с ацетатом свинца Pb(CH 3 COO) 2 дает черный или бурый осадок сульфида свинца;
o реакция с нитропруссидом – Na 2 S дает с нитропруссидом натрия соединение, окрашенное в красно-коричневый цвет.
Проведение анализа
5 капель 1% раствора белка и 5 капель 30% раствора NaOH кипятить 1‑2 минуты. Разделить содержимое на 2 части для реакций "а" и "б".
а) Реакция Фоля
К 5 каплям гидролизата добавляют 1 каплю раствора уксусно-кислого свинца и нагревают до кипения. Отмечают появление бурого или черного осадка.
б) Реакция с нитропруссидом
К 5 каплям гидролизата добавляют 2-3 капли раствора 5% натрия нитропруссида. Отмечают появление красно-коричневого окрашивания.
| Исследуемый материал | Окраска продукта | Реагирующая группа |
| Биуретовая реакция | ||
| Вода | ||
| Казеин | ||
| Яичный белок | ||
| Желатин | ||
| Аминокислота | ||
| Нингидриновая реакция | ||
| Вода | ||
| Казеин | ||
| Яичный белок | ||
| Желатин | ||
| Аминокислота | ||
| Ксантопротеиновая реакция | ||
| Казеин | ||
| Яичный белок | ||
| Желатин | ||
| Фенол | ||
| Реакция Фоля (на слабосвязанную серу) | ||
| Вода | ||
| Казеин | ||
| Яичный белок | ||
| Желатин |
НИНГИДРИНОВАЯ РЕАКЦИЯ. В этой реакции растворы белка, полипептидов, пептидов и свободных α-аминокислот при нагревании с нингидрином дают синее, сине-фиолетовое или розово-фиолетовое окрашивание. Окраска в этой реакции развивается за счет α-аминогруппы. Реакция протекает в две стадии.
Нингидрин образует с аминокислотами соединения с двойной связью между углеродом и азотом, называемые иминами или основаниями Шиффа.
|
|
Очень легко реагируют с нингидрином a-аминокислоты. Наряду с ними сине-фиолетовый Руэмана образуют также белки, пептиды, первичные амины, аммиак и некоторые другие соединения. Вторичные амины, например пролин и оксипролин, дают желтую окраску.
Нингидриновую реакцию широко используют для обнаружения и количественного определения аминокислот.
ХОД РАБОТЫ. Берут пять пробирок, и вносят по 1 мл: в первую воды, во вторую – раствора казеина, в третью – раствора яичного белка, в четвертую – раствора желатины, в пятую – раствора аминокислоты (глицина). Затем в каждую пробирку добавляют по 10-12 капель раствора с массовой долей нингидрина в ацетоне или этаноле 1 %. Содержимое каждой пробирки перемешивают встряхиванием и ставят их в кипящую водяную баню на 3-5 мин. Записывают химизм реакции, схему постановки опыта, строение окрашенных соединений. Результаты вносят в табл. 1.
КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ. Эта реакция указывает на наличие в белках остатков ароматических аминокислот – тирозина, фенилаланина, триптофана. Основана на нитровании бензольного кольца радикалов этих аминокислот с образованием нитросоединений, окрашенных в желтый цвет (греческое «Ксантос» – желтый). На примере тирозина эту реакцию можно описать в виде следующих уравнений.
 |
Тирозин Нитротирозин
|
В щелочной среде нитропроизводные аминокислот образуют соли хиноидной структуры, окрашенные в оранжевый цвет.
Ксантопротеиновую реакцию дают бензол и его гомологи, фенол и другие ароматические соединения.
ХОД РАБОТЫ. Берут четыре пробирки и вносят по 1 мл: в первую раствора казеина, во вторую – раствора яичного белка, в третью – раствора желатины, в четвертую – раствора фенола. Во все пробирки добавляют по 10 капель концентрированной азотной кислоты. Содержимое перемешивают встряхиванием и пробирки помещают в кипящую водяную баню на 5-8 мин. Под действием кислоты появляется осадок белка, который при нагревании окрашивается в желтый цвет. После бани пробирки выдерживают при комнатной температуре 4-5 мин и записывают окраску содержимого. Затем в каждую пробирку прибавляют по 1 мл раствора с массовой долей гидроксида натрия 30 % (или другую щелочь). Содержимое пробирок перемешивают встряхиванием, окраску записывают. Работу оформляют в соответствии с табл.1.
РЕАКЦИЯ ФОЛЯ (на слабосвязанную серу). Этой реакцией открывают в белках радикалы цистеина содержащие как свободные –SH (тиоловые) радикальные группы, так и окисленные с образованием дисульфидных (-S-S-) связей цистина.
При нагревании белка, содержащегося в молекуле остатки цистеина и цистина, с концентрированным раствором щелочи и ацетатом (или другой растворимой солью) свинца (реактив Фоля) образуется бурое или черное окрашивание. Это объясняют тем, что под действием щелочи от радикалов цистеина отщепляется сера в виде иона со степенью окисления минус два, который, взаимодействуя с ионом свинца (II), дает бурый или черный нерастворимый осадок сульфида свинца. Белки, в составе которых нет цистина и цистеина, реакцию Фоля не дают. Химизм процесса можно описать следующими реакциями:
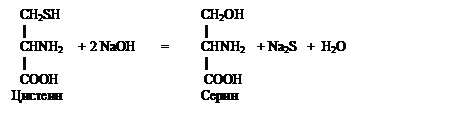 |
Na 2 S + Pb(CH 3 COO) 2 = PbS + 2CH 3 COONa
Ацетат свинца Ацетат натрия
При нагревании со щелочью часть белка подвергается гидролизу. Кроме того происходит отщепление части аминогрупп (реакция дезаминирования) в виде аммиака, который можно обнаружить по запаху и посредством смоченной водой красной лакмусовой бумажки, поднесенной к отверстию пробирки (не касаться стенок!).
ХОД РАБОТЫ. Берут четыре пробирки и вносят по 1 мл: в первую воды, во вторую – раствора казеина, в третью – раствора яичного белка, в четвертую – раствора желатины. В каждую пробирку добавляют по 1 мл раствора с массовой долей гидроксида натрия 30 % и по 6-8 капель раствора с массовой долей ацетата свинца 5 %, или можно приготовить реактив Фоля на всю подгруппу и добавить по 1 мл в каждую пробирку приготовленного раствора. Содержимое перемешивают встряхиванием, и пробирки помещают в кипящую водяную баню на 5-7 мин. Окраску содержимого пробирок записывают. Результаты оформляют в табл. 1.
РЕАКТИВЫ.Вода дистиллированная (в дальнейшем вода); растворы с массовыми долями: казеина 1 %, желатины 1 %, яичного белка 1 %, сульфата меди 1 %, гидроксида натря 10 и 30 %, глицина (или другой аминокислоты) 0,1 %, фенола 0,1 %, ацетата свинца 5 %, нингидрина в ацетоне или этаноле 1 %; концентрированная азотная кислота.
Реактив Фоля готовят в пробирке перед определением. В пробирку вносят 1 мл 5 % раствора ацетата свинца и небольшими порциями (по 1,5-2 мл) приливают 30 % раствор гидроксида натрия с интервалом 30 сек, каждый раз, перемешивая, до растворения молочно-белого хлопьевидного осадка появившегося после внесения первой порции гидроксида натрия.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Общая характеристика пептидов, полипептидов, белков и их строения.
2. Как соединяются аминокислоты в молекуле белка и за счет каких групп? Соедините Ала, Цис, Сер.
3. Перечислите цветные реакции на белки и аминокислоты.
4. Какая реакция открывает пептидные связи? Её химизм.
5. Что характеризуют цвет и интенсивность окраски при положительной биуретовой реакции?
6. Что открывает нингидриновая реакция? Её химизм.
7. Назовите аминокислоты имеющие в радикале бензольное кольцо. Какой реакцией можно обнаружить ароматические аминокислоты? Её химизм.
8. Назовите аминокислоты содержащие серу. Какую из них обнаруживает реакция Фоля? Химизм реакции.
9. Какую цветную реакцию используют для количественного определения белков в растворе и почему?
10. Какую цветную реакцию используют для количественного определения α-аминокислот и почему?
ОПРЕДЕЛЕНИЕ
Белки - это высокомолекулярные соединения. Их условно можно отнести к группе полимеров.
Мономерными звеньями белков выступают пептиды, которые состоят из аминокислот. Если вещество содержит более, чем 100 аминокислотных остатков его классифицируют как протеин, менее 100 - это ещё пептид. Образование белков (пептидная связь) схематично можно изобразить следующим образом:
Гидролиз белков
Белки способны частично гидролизоваться. Если представить, что гидролиз протекает до конца, т.е. полностью, то в качестве продуктов реакции получается смесь аминокислот. Кроме этих веществ в растворе после гидролиза были найдены углеводы, пиримидиновые и пуриновые основания, ортофосфорная кислота. Гидролиз белков протекает при определенных условиях: кипячение в растворе кислоты или щелочи.
Если в составе белков имеются амидные связи за счет наличия аминокислот с разветвленными боковыми радикалами, создающими стерические препятствия, как например в лейцине или валине, то гидролиз невозможен.
Если белок распадается на составляющие в щелочной среде, то гидролиз проводят в кислой и наоборот.
Условно уравнение реакции гидролиза белков можно записать как:

Для чего нужен гидролиз белков?
Поскольку белки являются высокомолекулярными соединения, то они могут плохо восприниматься организмом, так как любой продукт питания, растительного или животного происхождения имеет в составе белки. Гидролиз разрушает белки до низкомолекулярных продуктов, поэтому его используют для ускорения усвояемости белков (спортивное питание), снижения аллергических реакций (детское питание, в особенности молочные смеси), получения аминокислот.
Примеры решения задач
ПРИМЕР 1
Белки- это высокомолекулярные (молекулярная масса варьируется от 5-10 тыс. до 1 млн и более) природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью.
Белки также называют протеинами (греч. «протос» - первый, важный). Число остатков аминокислот в молекуле белка очень сильно колеблется и иногда достигает нескольких тысяч. Каждый белок обладает своей присущей ему последовательностью расположения аминокислотных остатков.
Белки выполняют разнообразные биологические функции: каталитические (ферменты), регуляторные (гормоны), структурные (коллаген, фиброин), двигательные (миозин), транспортные (гемоглобин, миоглобин), защитные (иммуноглобулины, интерферон), запасные (казеин, альбумин, глиадин) и другие.
Белки - основа биомембран, важнейшей составной части клетки и клеточных компонентов. Они играют ключевую роль в жизни клетки, составляя как бы материальную основу ее химической деятельности.
Исключительное свойство белка - самоорганизация структуры , т. е. его способность самопроизвольно создавать определенную, свойственную только данному белку пространственную структуру. По существу, вся деятельность организма (развитие, движение, выполнение им различных функций и многое другое) связана с белковыми веществами. Без белков невозможно представить себе жизнь.
Белки - важнейшая составная часть пищи человека и животных, поставщик необходимых аминокислот.
Строение белков
В пространственном строении белков большое значение имеет характер радикалов (остатков) R- в молекулах аминокислот. Неполярные радикалы аминокислот обычно располагаются внутри макромолекулы белка и обусловливают гидрофобные взаимодействия; полярные радикалы, содержащие ионогенные (образующие ионы) группы, обычно находятся на поверхности макромолекулы белка и характеризуют электростатические (ионные) взаимодействия. Полярные неионогенные радикалы (например, содержащие спиртовые ОН-группы, амидные группы) могут располагаться как на поверхности, так и внутри белковой молекулы. Они участвуют в образовании водородных связей.
В молекулах белка α-аминокислоты связаны между собой пептидными (-СО-NH-) связями:
Построенные таким образом полипептидные цепи или отдельные участки внутри полипептидной цепи могут быть в некоторых случаях дополнительно связаны между собой дисульфидными (-S-S-) связями или, как их часто называют, дисульфидными мостиками.
Большую роль в создании структуры белков играют ионные (солевые) и водородные связи, а также гидрофобное взаимодействие - особый вид контактов между гидрофобными компонентами молекул белков в водной среде. Все эти связи имеют различную прочность и обеспечивают образование сложной, большой молекулы белка.
Несмотря на различие в строении и функциях белковых веществ, их элементный состав колеблется незначительно (в % на сухую массу): углерода - 51-53; кислорода - 21,5-23,5; азота - 16,8-18,4; водорода - 6,5-7,3; серы - 0,3-2,5.
Некоторые белки содержат в небольших количествах фосфор, селен и другие элементы.
Последовательность соединения аминокислотных остатков в полипептидной цепи получила название первичной структуры белка.
Белковая молекула может состоять из одной или из нескольких полипептидных цепей, каждая из которых содержит различное число аминокислотных остатков. Учитывая число их возможных комбинаций, можно сказать, что разнообразие белков почти безгранично, но не все из них существуют в природе.
Общее число различных типов белков у всех видов живых организмов составляет 10 11 -10 12 . Для белков, строение которых отличается исключительной сложностью, кроме первичной, различают и более высокие уровни структурной организации: вторичную, третичную, а иногда и четвертичную структуры.
Вторичной структурой обладает большая часть белков, правда, не всегда на всем протяжении полипептидной цепи. Полипептидные цепочки с определенной вторичной структурой могут быть по-разному расположены в пространстве.
В формировании третичной структуры , кроме водородных связей, большую роль играют ионное и гидрофобное взаимодействия. По характеру «упаковки» белковой молекулы различают глобулярные , или шаровидные, и фибриллярные , или нитевидные, белки (табл. 12).
Для глобулярных белков более характерна а-спиральная структура, спирали изогнуты, «свернуты». Макромолекула имеет сферическую форму. Они растворяются в воде и солевых растворах с образованием коллоидных систем. Большинство белков животных, растений и микроорганизмов относится к глобулярным белкам.

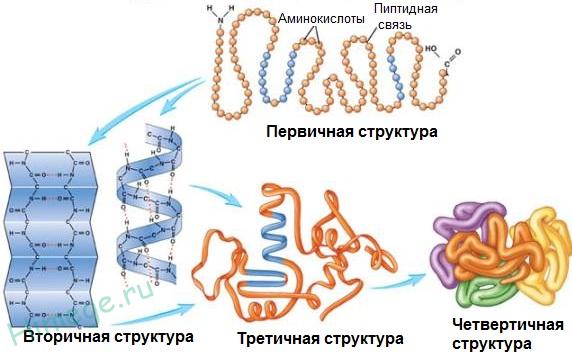
Для фибриллярных белков более характерна нитевидная структура. Они, как правило, не растворяются в воде. Фибриллярные белки обычно выполняют структурообразующие функции. Их свойства (прочность, способность растягиваться) зависят от способа упаковки полипептидных цепочек. Примером фибриллярных белков служат миозин, кератин. В ряде случаев отдельные субъединицы белка с помощью водородных связей, электростатического и других взаимодействий образуют сложные ансамбли. В этом случае образуется четвертичная структура белков.
Примером белка с четвертичной структурой служит гемоглобин крови. Только с такой структурой он выполняет свои функции - связывание кислорода и транспортировка его в ткани и органы.
Однако следует отметить, что в организации более высоких структур белка исключительная роль принадлежит первичной структуре.
Классификация белков
Существует несколько классификаций белков:
- По степени сложности (простые и сложные).
- По форме молекул (глобулярные и фибриллярные белки).
- По растворимости в отдельных растворителях (водорастворимые, растворимые в разбавленных солевых растворах- альбумины, спирторастворимые - проламины, растворимые в разбавленных щелочах и кислотах - глутелины).
- По выполняемым функциям (например, запасные белки, скелетные и т. п.).
Свойства белков
Белки - амфотерные электролиты. При определенном значении pH среды (оно называется изоэлектрической точкой) число положительных и отрицательных зарядов в молекуле белка одинаково. Это одно из основных свойств белка. Белки в этой точке электронейтральны, а их растворимость в воде наименьшая. Способность белков снижать растворимость при достижении электронейтральности их молекул используется для выделения из растворов, например, в технологии получения белковых продуктов.
Гидратация . Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объем увеличиваются. Набухание отдельных белков зависит исключительно от их строения. Имеющиеся в составе и расположенные на поверхности белковой макромолекулы гидрофильные амидные (-СО-NH-, пептидная связь), аминные (-NH 2) и карбоксильные (-СООН) группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы. Окружающая белковые глобулы гидратная (водная) оболочка препятствует агрегации и осаждению, а следовательно, способствует устойчивости растворов белка. В изоэлектрической точке белки обладают наименьшей способностью связывать воду, происходит разрушение гидратной оболочки вокруг белковых молекул, поэтому они соединяются, образуя крупные агрегаты. Агрегация белковых молекул происходит и при их обезвоживании с помощью некоторых органических растворителей, например, этилового спирта. Это приводит к выпадению белков в осадок. При изменении pH среды макромолекула белка становится заряженной, и его гидратационная способность меняется.
При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями .
Студни не текучи, упруги, обладают пластичностью, определенной механической прочностью, способны сохранять свою форму. Глобулярные белки могут полностью гидратироваться, растворяться в воде (например, белки молока), образуя растворы с невысокой концентрацией. Гидрофильные свойства белков, т. е. их способность набухать, образовывать студни, стабилизировать суспензии, эмульсии и пены, имеют большое значение в биологии и пищевой промышленности. Очень подвижным студнем, построенным в основном из молекул белка, является цитоплазма - сырая клейковина, выделенная из пшеничного теста; она содержит до 65 % воды. Различная гидрофильность клейковинных белков - один из признаков, характеризующих качество зерна пшеницы и получаемой из него муки (так называемые сильные и слабые пшеницы). Гидрофильность белков зерна и муки играет большую роль при хранении и переработке зерна, в хлебопечении. Тесто, которое получают в хлебопекарном производстве, представляет собой набухший в воде белок, концентрированный студень, содержащий зерна крахмала.
Денатурация белков . При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и ряда других факторов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы, т. е. ее нативной пространственной структуры. Первичная структура, а следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой макромолекулы, происходит агрегирование. В то же время увеличивается активность некоторых химических групп, облегчается воздействие на белки протеолитических ферментов, а следовательно, он легче гидролизуется.
В пищевой технологии особое практическое значение имеет тепловая денатурация белков, степень которой зависит от температуры, продолжительности нагрева и влажности. Это необходимо помнить при разработке режимов термообработки пищевого сырья, полуфабрикатов, а иногда и готовых продуктов. Особую роль процессы тепловой денатурации играют при бланшировании растительного сырья, сушке зерна, выпечке хлеба, получении макаронных изделий. Денатурация белков может вызываться и механическим воздействием (давлением, растиранием, встряхиванием, ультразвуком). Наконец, к денатурации белков приводит действие химических реагентов (кислот, щелочей, спирта, ацетона). Все эти приемы широко используются в пищевой и биотехнологии.
Пенообразование . Под процессом пенообразования понимают способность белков образовывать высококонцентрированные системы «жидкость - газ», называемые пенами. Устойчивость пены, в которой белок является пенообразователем, зависит не только от его природы и от концентрации, но и от температуры. Белки в качестве пенообразователей широко используются в кондитерской промышленности (пастила, зефир, суфле). Структуру пены имеет хлеб, а это влияет на его вкусовые качества.
Молекулы белков под влиянием ряда факторов могут разрушаться или вступать во взаимодействие с другими веществами с образованием новых продуктов. Для пищевой промышленности можно выделить два важных процесса:
1) гидролиз белков под действием ферментов;
2) взаимодействие аминогрупп белков или аминокислот с карбонильными группами восстанавливающих сахаров.
Под влиянием ферментов протеаз, катализирующих гидролитическое расщепление белков, последние распадаются на более простые продукты (поли- и дипептиды) и в конечном итоге на аминокислоты. Скорость гидролиза белка зависит от его состава, молекулярной структуры, активности фермента и условий.
Гидролиз белков. Реакцию гидролиза с образованием аминокислот в общем виде можно записать так:

Горение . Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жженых перьев.
Цветные реакции на белки . Для качественного определения белка используют следующие реакции:
1) ксантопротеиновую, при которой происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением желтой окраски.
2) биуретовую , при которой происходит взаимодействие слабощелочных растворов белков с раствором сульфата меди (II) с образованием комплексных соединений между ионами Сu 2+ и полипептидами. Реакция сопровождается появлением фиолетово-синей окраски.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Государственное Бюджетное Образовательное Учреждение
Высшего профессионального образования
«Сибирский Государственный медицинский Университет»
Министерства Здравоохранения и Социального Развития Российской Федерации
Кафедра химии
на тему: Белки
Выполнила: Темнова М.Д.
Проверила: Прищепова О.Ф.
Томск, 2015г.
2. Классификация белков
3. Строение белков
4. Качественные реакции на белки
5. Физико-химические свойства белков
6. Белковые препараты, аминокислоты и заменители Белка
Список литературы
1. Белки
Белки - это азотсодержащие высокомолекулярные органические вещества со сложным составом и строением молекул.
Общая формула:
Белок можно рассматривать как сложный полимер аминокислот.
Белки входят в состав всех живых организмов, но особо важную роль они играют в животных организмах, которые состоят из тех или иных форм белков (мышцы, покровные ткани, внутренние органы, хрящи, кровь).
Растения синтезируют белки (и их составные части -аминокислоты) из углекислого газа СО 2 и воды Н 2 О за счет фотосинтеза, усваивая остальные элементы белков (азот N, фосфор Р, серу S, железо Fe, магний Mg) из растворимых солей, находящихся в почве.
Животные организмы в основном получают готовые аминокислоты с пищей и на их базе строят белки своей организма. Ряд аминокислот (заменимые аминокислоты) могут синтезироваться непосредственно животными организмами.
Характерной особенностью белков является их многообразие, связанное с количеством, свойствами и способах соединения входящих в их молекулу аминокислот. Белки выполняют функцию биокатализаторов -- ферментов, регулирующих скорость и направление химических реакций в организме. В комплексе с нуклеиновыми кислотами обеспечивают функции роста и передачи наследственных признаков, являются структурной основой мышц и осуществляют мышечное сокращение.
В молекулах белков содержатся повторяющиеся амидные связи С(0)--NH, названные пептидными (теория русского биохимика А.Я.Данилевского).
Таким образом, белок представляет собой полипептид, содержащий сотни или тысячи аминокислотных звеньев.
белковый химический гидратация аминокислота
2. Классификация белков
Классификация белков в значительной мере условна и построена на различных, часто случайных, признаках. Белки разделяют на животные, растительные и бактериальные, на фибриллярные и глобулярные, мышечные, нервной ткани и т. п. Учитывая исключительное многообразие белков, ни одну классификацию нельзя считать удовлетворительной, поскольку многие индивидуальные белки не подходят ни к одной группе. Обычно принято делить Б. на простые (протеины), состоящие только из остатков аминокислот, и сложные (протеиды), содержащие также простетические (небелковые) группы.
· Простые белки (протеины).
· 1) Альбумины -- глобулярные белки. Растворимы в чистой воде и солевых растворах. Осаждаются при насыщении раствора сернокислым аммонием. Типичные представители: яичный альбумин, альбумин сыворотки крови.
· 2) Глобулины -- глобулярные белки, но более высокого молекулярного веса. Растворимы в разведенных растворах солей, не растворимы в чистой воде. Осаждаются в полунасыщенном растворе сернокислого аммония. К этой группе относятся глобулины сыворотки крови, молока, эдестин конопли и ряд других животных и растительных белков.
· 3) Проламины (глиадины) -- белки семян злаков. Растворимы в 70--80% спирте и не растворимы в воде. Относительно богаты пролином и глютаминовой кислотой. Типичные представители: глиадин пшеницы, гордеин ячменя, зеин кукурузы.
· 4) Глютелины -- белки злаков. Растворимы в разведенных кислотах или щелочах, но не в нейтральных растворах.
· 5) Склеропротеины (альбуминоиды, протеиноиды) -- нерастворимые в воде, солевых растворах, разведенных кислотах и щелочах, главным образом животного происхождения, несущие структурные (чаще опорные) функции. Склеропротеины -- обычно фибриллярные белки, весьма устойчивые к действию пищеварительных ферментов. К ним относятся фибриллярные белки соединительной ткани, коллагены , содержащиеся в костях, коже, сухожилиях. Для коллагенов характерно образование при нагревании с водой желатины, которая застывает в гель при охлаждении, плавится при нагревании. Коллагены содержат много пролина и особенно оксипролина. Другую группу соединительнотканных белков представляют эластины . К склеропротеинам относятся также кератины волос, шерсти, богатые цистином, и фиброины шелка, паутины и т. п.
· 6) Протамины -- белки основного характера, содержащиеся в сперме некоторых рыб и других животных в виде комплексов с ДНК. Имеют сравнительно небольшой молекулярный вес, содержат очень много аргинина и немного некоторых моноаминомонокарбоновых кислот. Иногда в их состав входят лизин и гистидин. Наиболее изучены клупеин (протамин из спермы сельди), сальмин (из спермы лосося).
· 7) Гистоны -- белки менее выраженного основного характера, богатые диаминомонокарбоновыми кислотами. Входят в состав нуклеопротеидов клеточных ядер.
· Сложные белки (протеиды).
· Нуклеопротеиды -- комплексы белка с нуклеиновыми кислотами. Имеют очень высокий молекулярный вес. Играют важнейшую роль в биосинтезе белка в организме, в передаче наследственных признаков и т. п.
· 1) Мукопротеиды -- белки, содержащие мукополисахариды -- углеводные группировки кислого характера (муцины, мукоиды). Содержатся главным образом в слизях, слюне, синовиальной жидкости и т. п.
· 2) Фосфопротеиды содержат фосфорную кислоту, обычно в виде сложного эфира с оксигруппой серина. Главные представители: казеин молока, вителлин яичного желтка.
· 3) Металлопротеиды -- комплексы белков с металлами или органическими группировками, содержащими атомы металлов. К ним относятся многие хромопротеиды (белки, содержащие окрашенные группировки), например гемоглобин и другие пигменты крови, многие ферменты, например оксидазы, содержащие железо или медь, и др.
· 4) Липопротеиды -- комплексы белков с различными липидами. В крови играют большую роль в переносе липидов. Входят в состав клеточных оболочек и внутренних мембран клеточных структур.
Также существует классификация белков в зависимости от выполняемых функций по классам:
|
Каталитическая. Наиболее многочисленная группа белков - это белки-ферменты, катализирующие биохимические реакции. С помощью белков-ферментов в живой клетке достигается закономерная последовательность химических превращений веществ, обеспечивающая жизнедеятельность организмов. |
Оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы) |
|
|
Транспортные. Переносят специфические молекулы или ионы. |
Гемоглобин (связывает кислород и переносят его к периферическим тканям), гемоцианин, альбумин, миоглобин |
|
|
Структурные. Входят в состав покровных тканей растений. Они составляют также структурную основу биомембран клеток, обеспечивая сохранение органеллами клетки необходимой последовательности биохимических реакций. |
Коллаген Кератин Эластин Гистоны, фиброин |
|
|
Регуляторные. Эти белки участвуют в регуляции обменных реакций. |
Соматотропин, инсулин, глюкагон, тропомиозин, тиротропин, гонадотропин, паратгормон |
|
|
Защитные. Защитные белки предохраняют живой организм от разрушения или способствуют его выживанию при повреждении. Защитная функция белков - токсинов, вырабатываемых растениями, заключается в том, что они защищают растения от поедания их животными, а также ингибируют протеолитические ферменты насекомых-вредителей, повреждающих семена многих растений. |
Иммуноглобулин, интерфероны, фибриноген, фибрин, протромбин, тромбин |
|
|
Запасные. Запасные белки в больших количествах накапливаются в клетках зерна и семян при созревании на растении, а затем при прорастании гидролизуются до аминокислот или молекулярных пептидов, используемых затем клеткой для формирования нового растения на ранних стадиях развития. В животном организме белки в запас не откладываются поэтому должны поступать вместе с пищей ежедневно в необходимых количествах. |
У животных - ферритин, альбумин, казеин У растений - легумины и вицилины (семена гороха), глютен, пролин, серин (семена пшеницы), оризенин (семена риса) |
|
|
Сократительные. В акте мышечного сокращения и расслабления участвует множество белковых веществ. Однако главную роль в этих жизненно важных процессах играют актин и миозин - специфические белки мышечной ткани. Сократительная функция присуща не только мышечным белкам, но и белкам цитоскелета, что обеспечивает тончайшие процессы жизнедеятельности клеток (расхождение хромосом в процессе митоза). |
Миозин, актин, тубулин |
3. Строение белков
Среди органических веществ белки , или протеины , -- самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. На их долю приходится 50 -- 80% сухой массы клетки.
Молекулы белков имеют большие размеры, поэтому их называют макромолекулами . Кроме углерода, кислорода, водорода и азота, в состав белков могут входить сера, фосфор и железо. Белки отличаются друг от друга числом (от ста до нескольких тысяч), составом и последовательностью мономеров. Мономерами белков являются аминокислоты.
Бесконечное разнообразие белков создается за счет различного сочетания всего 20 аминокислот. Каждая аминокислота имеет свое название, особое строение и свойства. Их общую формулу можно представить в следующем виде:
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (--NH 2 ) с основными свойствами, другая -- карбоксильной группой (--COOH ) с кислотными свойствами. Часть молекулы, называемая радикалом (R ), у разных аминокислот имеет различное строение. Наличие в одной молекуле аминокислоты основной и кислотной групп обусловливает их высокую реакционную способность. через эти группы происходит соединение аминокислот при образовании белка. При этом возникает молекула воды, а освободившиеся электроны образуют пептидную связь. Поэтому белки называют полипептидами .
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
1. Первичная структура.
Последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка. Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в в-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию -- транспорт кислорода; в таких случаях у человека развивается заболевание -- серповидноклеточная анемия.
Методы изучения первичной структуры белка.
Изучение первичной структуры белков имеет важное общебиологическое и медицинское значение. Изучая порядок чередования аминокислотных остатков в индивидуальных белках и сопоставляя эти знания с особенностями пространственного расположения молекулы, можно выявить общие фундаментальные закономерности формирования пространственной структуры белков.
Кроме того, многие генетические болезни - результат нарушения в аминокислотной последовательности белков. Информация о первичной структуре нормального и мутантного белка может быть полезна для диагностики и прогнозирования развития заболевания.
Установление первичной структуры белков включает 2 основных этапа:
* определение аминокислотного состава изучаемого белка;
* определение аминокислотной последовательности в белке.
2. Вторичная структура.
Большинство белков имеют вид спирали в результате образования водородных связей между--CO- и --NH- группами разных аминокислотных остатков полипептидной цепи. Водородные связи малопрочные, но в комплексе они обеспечивают довольно прочную структуру. Эта спираль -- вторичная структура белка. При этом пептидные цепи могут приобретать регулярные структуры двух типов: б-спираль и в-структура.
б- Спираль
В данном типе структуры пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали. На один виток б-спирали приходится 3,6 аминокислотных остатка.
В образовании водородных связей участвуют практически все атомы кислорода и водорода пептидных групп. В результате б-спираль «стягивается» множеством водородных связей. Несмотря на то что данные связи относят к разряду слабых, их количество обеспечивает максимально возможную стабильность б-спирали. Так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т.е. способность образовывать водородные связи с водой) б-спиралей уменьшается, а их гидрофобность увеличивается. б-Спиральная структура - наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии. В результате образования б-спиралей полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится.
в- Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями. в-Структура образует фигуру, подобную листу, сложенному «гармошкой», - в-складчатый слой.
Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными. В в-структурах водородные связи расположены перпендикулярно полипептидной цепи.
Если связанные полипептидные цепи направлены противоположно, возникает антипараллельная в-структура, если же N- и С-концы полипептидных цепей совпадают, образуется структура параллельного в-складчатого слоя.
3. Третичная структура.
Третичная структура -- трехмерная пространственная «упаковка» полипептидной цепи. В результате возникает причудливая, но для каждого белка специфическая конфигурация --глобула . Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот.
4. Четвертичная структура характерна не для всех белков. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех макромолекул белка.
Такая сложность структуры белковых молекул связана с разнообразием функций, свойственных этим биополимерам.
Нарушение природной структуры белка называют денатурацией . Она может происходить под воздействием температуры, химических веществ, лучистой энергии и других факторов. При слабом воздействии распадается только четвертичная структура, при более сильном -- третичная, а затем -- вторичная, и белок остается в виде полипептидной цепи.
Этот процесс частично обратим: если не нарушена первичная структура, то денатурированный белок способен восстанавливать свою структуру. Отсюда следует, что все особенность строение макромолекулы белка определяются его первичной структурой.
4. Качественные реакции на белки
· РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа -С(О)-NН- называется пептидной группой, связь С-N, соединяющая остатки молекул аминокислот, - пептидной связью. При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д. Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
· КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ
Эта реакция используется для обнаружения -аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих -аминокислот дают соли, окрашенные в оранжевый цвет:
· РЕАКЦИЯ ФОЛЯ
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, даёт сульфиды натрия и калия. При добавлении ацетата свинца (II) образуется осадок сульфида свинца (II) серо-черного цвета:
· НИНГИДРИНОВАЯ ПРОБА (реакция Руэманна)
Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты:
· РЕАКЦИЯ САКАГУЧИ
Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с a-нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
· РЕАКЦИЯ МИЛЛОНА
Эта реакция на аминокислоту тирозин. Реактив Миллона (раствор HgNO 3 и Hg(NO 2) 2 в разбавленной HNO 3 , содержащей примесь HNO 2) взаимодействует с тирозином с образованием ртутной соли нитропроизводного тирозина, окрашенной в розовато-красный цвет:
ртутные соли нитропроизводного тирозина (розовый цвет)
· РЕАКЦИЯ АДАМКЕВИЧА
Цветная качественная реакция на триптофан и триптофансодержащие белки, основанная на фиолетово-синем окрашивании их растворов после добавления глиоксиловой и концентрированной серной кислот.
· РЕКЦИЯ ЭРЛИХА
Взаимодействие 4-диметиламинобензальдегида (т.н. реагент Эрлиха) с триптофаном или его остатками в белках (пептидах) по схеме:
5. Физико-химические свойства белков
Аминокислотный состав и пространственная организация каждого белка определяют его физико-химические свойства. Белки обладают кислотно-основными, буферными, коллоидными и осмотическими свойствами.
Коллоидные и осмотические свойства белков
Поведение белков в растворах имеет некоторые особенности. Обычные коллоидные растворы устойчивы только в присутствии стабилизатора, который препятствует осаждению коллоидов, располагаясь на границе раздела "растворенное вещество -- растворитель".
Водные растворы белков являются устойчивыми и равновесными, они со временем не выпадают в осадок (не коагулируют) и не требуют присутствия стабилизаторов. Белковые растворы гомогенны и, в сущности, их можно отнести к истинным растворам. Однако высокая молекулярная масса белков придает их растворам многие свойства коллоидных систем:
· характерные оптические свойства (опалесценция растворов и способность их рассеивать лучи видимого света)
· малая скорость диффузии
· неспособность проникать через полупроницаемые мембраны
· высокая вязкость растворов
· способность к образованию гелей
Гидратация белков и факторы, влияющие на их растворимость
Белки -- гидрофильные вещества. Если растворять сухой белок в воде, то сначала он, как всякое гидрофильное высокомолекулярное соединение, набухает, а затем молекулы белка начинают постепенно переходить в раствор. При набухании молекулы воды проникают в белок и связываются с его полярными группами. Плотная упаковка полипептидных цепей разрыхляется. Набухший белок можно считать как бы обратным раствором, т. е. раствором молекул воды в высокомолекулярном веществе -- белке. Дальнейшее поглощение воды приводит к отрыву молекул белка от общей массы и растворению. Но набухание не всегда ведет к растворению; некоторые белки, например коллаген, так и остаются в набухшем виде, поглотив большое количество воды.
Растворение связано с гидратацией белков, т. е. связыванием молекул воды с белками. Гидратная вода так прочно связана с макромолекулой белка, что отделить ее удается с большим трудом. Это говорит не о простой адсорбции, а об электростатическом связывании молекул воды с полярными группами боковых радикалов кислых аминокислот, несущих отрицательный заряд, и основных аминокислот, несущих положительный заряд.
Факторы, влияющие на растворимость белков . Растворимость разных белков колеблется в широких пределах. Она определяется их аминокислотным составом (полярные аминокислоты придают большую растворимость, чем неполярные), особенностями организации (глобулярные белки, как правило, лучше растворимы, чем фибриллярные) и свойствами растворителя. Например, растительные белки -- проламины -- растворяются в 60-80%-ном спирте, альбумины -- в воде и в слабых растворах солей, а коллаген и кератины нерастворимы в большинстве растворителей.
Денатурация (денативация) и ренатурация (ренативация)
При действии различных веществ, нарушающих высшие уровни организации белковой молекулы (вторичную, третичную, четвертичную) с сохранением первичной структуры, белок теряет свои нативные физико-химические и, главное, биологические свойства. Это явление называется денатурацией (денативацией). Оно характерно только для молекул, имеющих сложную пространственную организацию. Синтетические и природные пептиды не способны к денатурации.
При денатурации разрываются связи, стабилизирующие четвертичную, третичную и даже вторичную структуры. Полипептидная цепь разворачивается и находится в растворе или в развернутом виде, или в виде беспорядочного клубка. При этом теряется гидратная оболочка и белок выпадает в осадок. Однако осажденный денатурированный белок отличается от того же белка, осажденного путем высаливания, так как в первом случае он утрачивает нативные свойства, а во втором сохраняет. Это указывает на то, что механизм действия веществ, вызывающих денатурацию и высаливание, разный. При высаливании сохраняется нативная структура белка, а при денатурации разрушается.
Денатурирующие факторы делятся на:
· физические;
· химические;
6. Бе лковые препараты, а минокислоты и з аменители Белка
Глобулины неспецифические (нормальные). Водный раствор глобулиновой фракции белка сыворотки крови животных. Прозрачный раствор. Содержит гамма- и бетаглобулины.
Действует стимулирующе, ускоряет рост и развитие животных.
Применяют для ускорения развития молодняка животных и предупреждения желудочно-кишечных заболеваний. Для лечения легочных и желудочно-кишечных заболеваний лучше использовать с химиотерапевтическими средствами. Препарат назначают подкожно или внутримышечно с первых дней жизни.
Нормальный иммуноглобулин . Комплексный препарат гамма-глобулина сыворотки крови (свиней) и серноватистокислого натрия. Слегка опалесцирующий раствор.
Действует и применяют подобно глобулинам неспецифическим.
Назначают для профилактики и лечения желудочнокишечных заболеваний совместно с антибиотиками и сульфаниламидами, для повышения резистентности и ускорения развития новорожденным животным.
Метионин. Белый кристаллический порошок, растворимый в воде. Получают синтетически. Метионин - незаменимая аминокислота, постоянно присутствующая в организме.
Действие. Участвует в обмене веществ, в обезвреживании в организме ядов и продуктов обмена, в синтезе многих гормонов, медиаторов, витаминов.
Применяют для ускорения роста и откорма свиней и птиц, для повышения яйценоскости птиц. Большое количество метионина содержит творог, который также используют цыплятам для ускорения их развития.
Для ускорения восстановительных процессов рекомендуется включать в меню специальные пищевые препараты. К ним относятся: питательная смесь «Эрготон», «Регузал», «Репирол», «Динвитол», сублимационные соки и другие средства, содержащие сбалансированный комплекс белков, жиров, углеводов, витаминов и микроэлементов.
Вывод
Белок в деятельности нашего организма играет важнейшую роль.
Он образовывает и формирует ткани наших органов и мышц. Он необходим при синтезе гормонов. Из белка образуются ферменты, без которых клеткам организма - хана. Нервная система тоже не может функционировать без белка, поскольку передача клеточной информации по нервной системе будет нарушена. Мы станем медленно и неправильно двигаться и тупо соображать. Иммунная система ослабнет, и малейшего дуновения ветерка нам хватит, чтобы подхватить ОРЗ. Без белков у вас не свернется кровь и, порезавшись при бритье или неосторожном обращении с ножом, вы рискуете истечь кровью без остатка.
Белок нормализует работу печени и почек и сказывается на здоровье нашей кожи. Если сократить потребление белка в значительной мере, стареть мы станем катастрофически быстро. Белок участвует в энергетических процессах организма и вырабатывает из 1 грамма 4 килокалории энергии.
И вообще, наше ДНК, - это молекулы белка, который является строительным материалом всего организма. Все это значит, что белки, так или иначе, участвуют в большинстве процессов, проистекающих в нашем организме, и без них - никак не обойтись. Белки не жиры, они не накапливаются. Стало быть, поступать в наш организм они должны постоянно и регулярно. Естественно, с пищей, в которой содержится белок.
А где содержится белок?
В молоке и рыбе. И быстрее всего переваривается. Белок в мясе переваривается несколько медленнее. И совсем медленно перевариваются белки растительного происхождения. Стало быть, для поддержания в порядке функций организма, основная масса белков должна быть животного происхождения. Соотношения - по науке - должно быть таково: 70% белков, поступающих в организм, должно быть происхождения животного (мясо, молоко, яйца и рыба, к примеру) и 30% - растительного (хлеб, горох, картошка). Причем, белки животного происхождения имеют абсолютно полный набор крайне нужных организму аминокислот, чего не скажешь о белке растительного происхождения. Полноценный белок растительного происхождения содержат только бобы. Так что, садясь на диету или отказываясь от мяса (и рыбы), мы просто губим свой организм, приводя его к разбалансировке и, как следствие, к гибели.
Список литературы
1) Электронный ресурс:
2) Электронный ресурс:
3) Электронный ресурс:
4) Электронный ресурс:
5) Электронный ресурс:
6) Электронный ресурс:
7) Биохимия: учебник для вузов/ под ред. Е.С.Северина - 5-е изд., - М. : ГЭОТАР-Медиа, 2009.
8) Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с. Электронный ресурс
Размещено на Allbest.ru
Подобные документы
Строение и основные свойства белков, их роль в живой природе. Пространственное строение белков. Качественные реакции на белки. Образование сгустков крови при ее свертывании. Белковые компоненты крови. Процесс образования и свертывания казеина.
презентация , добавлен 01.10.2012
Строение и общие свойства аминокислот, их классификация и химические реакции. Строение белковой молекулы. Физико-химические свойства белков. Выделение белков и установление их однородности. Химическая характеристика нуклеиновых кислот. Структура РНК.
курс лекций , добавлен 24.12.2010
Основные химические элементы, входящие в состав белков. Белки - полимеры, мономерами которых являются аминокислоты. Строение аминокислот, уровни организации белковых молекул. Структуры белка, основные свойства белков. Денатурация белка и ее виды.
презентация , добавлен 15.01.2011
Оценка сложившегося административно-территориального устройства России. Исследование белков. Классификация белков. Состав и строение. Химические и физические свойства. Химический синтез белков. Значение белков.
реферат , добавлен 13.04.2003
Общая характеристика, классификация, строение и синтез белков. Гидролиз белков с разбавленными кислотами, цветные реакции на белки. Значение белков в приготовлении пищи и пищевых продуктов. Потребность и усвояемость организма человека в белке.
курсовая работа , добавлен 27.10.2010
Белки как высокомолекулярные природные соединения, состоящие из остатков аминокислот, которые соединены пептидной связью. Качественный состав белков, их структура и функции. Процессы гидролиза (кислотно-основного, ферментативного) и денатурация белков.
презентация , добавлен 11.02.2015
Роль в живой природе. Состав и свойства белков. Классификация белков. Определение строения белков. Определение наличия белка. Идентификация белков и полипептидов. Синтез пептидов. Искусственное получение белка. Аминокислоты.
реферат , добавлен 01.12.2006
Строение и уровни укладки белковых молекул, конформация. Характеристика функций белков в организме: структурная, каталитическая, двигательная, транспортная, питательная, защитная, рецепторная, регуляторная. Строение, свойства, виды и реакции аминокислот.
реферат , добавлен 11.03.2009
Белки – высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот. Наследственная информация сосредоточена в молекуле ДНК. С помощью белков реализуется генетическая информация. Классификация аминокислот.
реферат , добавлен 17.01.2009
Понятие и основатели химии белка. Состав, уровень организации, структура белка. Денатурация, биуретовая реакция, гидролиз белков. Полноценные и неполноценные белки. Белки, жиры и углеводы - основа питания, их необходимое количество для человека.




