Открытие уксусной кислоты. Уксусная кислота
Уксусная кислота (Acetic acid, этановая кислота, E260) — слабая, предельная одноосновная карбоновая кислота.
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Химическая формула CH3COOH.
70-80% водный раствор уксусной кислоты называют уксусной эссенцией, а 3-6% — уксусом. Водные растворы уксусной кислоты широко используются в пищевой промышленности и бытовой кулинарии, а также в консервировании.
Продукт естественного скисания виноградных сухих вин и сбраживания спиртов и углеводов. Участвует в обмене веществ в организме. Широко применяется в приготовлении консервов, маринадов, винегретов.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Соли и эфиры уксусной кислоты называют ацетатами.
Пищевая добавка Е260 всем известна как уксусная кислота или уксус. Добавка Е260 используется в пищевой промышленности в качестве регулятора кислотности. В основном уксусная кислота применяется в виде водных растворов в пропорции 3-9% (уксус) и 70-80% (уксусная эссенция). Добавка Е260 имеет характерный резкий запах. В водных растворах регулятор кислотности Е260 представляет собой довольно слабую кислоту. В чистом же виде уксусная кислота представляет собой бесцветную едкую жидкость, поглощающую влагу из окружающей среды и замерзающую уже при температуре 16,5 °C с образованием твердых бесцветных кристаллов. Химическая формула уксусной кислоты: C 2 H 4 O 2 .
Уксус был известен еще несколько тысячелетий назад, как естественный продукт брожения пива или вина. В 1847 году немецкий химик Герман Кольбе впервые синтезировал уксусную кислоту в лабораторных условиях. Сейчас в мире природным методом добывается лишь 10% общего объема производства уксусной кислоты. Но натуральный метод брожения по прежнему важен, так как во многих странах действуют законы, согласно которым в пищевой промышленности должна использоваться лишь уксусная кислота биологического происхождения. При биохимическом производстве добавки Е260 используется способность некоторых бактерий окислять этанол (спирт). Данный метод известен как уксуснокислое брожение. В качестве сырья для производства добавки Е260 используются забродившие соки, вино или же раствор спирта в воде. Существует также ряд методов синтезирования уксусной кислоты в промышленности. Самый популярный из них, на который приходится более половины мирового синтеза уксусной кислоты, заключается в карбонилировании метанола в присутствии катализаторов. Исходными составляющими для данной реакции являются метанол (CH 3 OH) и окись углерода (CO).
Уксусная кислота имеет важное значение для работы человеческого организма. Ее производные помогают расщеплять в организме углеводы и жиры, поступающие в организм с продуктами питания. Уксусная кислота выделяется при жизнедеятельности некоторых видов бактерий, в частности Clostridium acetobutylicum и бактерий рода Acetobacter . Эти бактерии встречаются повсеместно в воде, почве, продуктах питания и естественным путем попадают в организм человека.
Токсическое воздействие добавки Е260 на организм человека зависит от степени разбавления уксусной кислоты водой. Опасным для здоровья и жизни считаются растворы, в которых концентрация уксусной кислоты выше 30%. Высококонцентрированная уксусная кислота при соприкосновении с кожей и слизистыми оболочками может вызывать сильные химические ожоги.
В пищевой промышленности добавка Е260 применяется для выпечки кондитерских изделий, консервирования овощей, производства майонезов и других продуктов питания.
Регулятор кислотности Е260 разрешен для использования в пищевых продуктах во всех странах, как добавка безопасная для здоровья человека.
Уксусная кислота также используется:
- в быту (удаление накипи из чайников, уход за поверхностями);
- в химической промышленности (в качестве растворителя и химреагента);
- в медицине (получение лекарственных средств);
- в других отраслях промышленности.
Пищевой консервант Е260 Уксусная кислота хорошо знаком всем людям, которые интересуются искусством гастрономии. Этот продукт представляет собой результат скисания виноградных вин в естественных условиях, при которых происходит сбраживание спирта и углеводов. Кроме того, известно, что уксусная кислота принимает непосредственное участие в процессах обмена веществ в организме человека.
Уксусной кислоте присущ резкий запах, однако в чистом виде она представляет собой совершенно бесцветную жидкость, способную поглощать влагу из окружающей среды. Замерзать данное вещество способно при температуре минус 16 градусов, в результате образуя прозрачные кристаллы.
Примечательно, что уксусом называется 3-6% раствор уксусной кислоты, в то время как при 70-80 процентном содержании получается уксусная эссенция. Растворы Е260 на основе воды широко используются не только в пищевой промышленности, но и в бытовой кулинарии. Основное применение пищевого консерванта Е260 Уксусная кислота - изготовление маринадов и консервов.
Кроме того, активно добавляется это вещество и при промышленном производстве ряда кондитерских изделий, а также майонезов и консервированных овощей. Нередко при особой необходимости пищевой консервант Е260 Уксусная кислота может быть применен в качестве дезинфицирующего и обеззараживающего средства.
Однако область изготовления продуктов питания - не единственная сфера использования пищевого консерванта Е260. Так, его широко применяют в химическом производстве при получении органического стекла, ацетатного волокна, а также при изготовлении эфиров и медикаментов.
Кстати, в фармакологии широко используют так называемый уксусный эфир, который более известен человеку под названием ацетилсалициловая кислота или аспирин. В качестве растворителя уксусная кислота тоже помогает людям в ряде случаев, а выделенные из ее состава соли успешно используются в борьбе с вредителями растений.
Вред пищевого консерванта Е260 Уксусная кислота
Вред пищевого консерванта Е260 Уксусная кислота для человека особенно очевиден при употреблении данного вещества в высоких концентрациях, так как в таком виде оно очень токсично. К слову, степень токсичности кислоты напрямую зависит от того, насколько ее разбавили водой. Самыми опасными для здоровья считаются растворы, концентрация которых превышает 30 процентов. При контакте слизистых оболочек или кожи с концентрированной уксусной кислотой возникают сильнейшие химические ожоги.
Пищевой консервант Е260 Уксусная кислота допущен для использования в пищевой промышленности во всех странах мира, так как не считается опасным для здоровья. Единственное, что рекомендуют специалисты во избежание вероятного вреда пищевого консерванта Е260 Уксусная кислота - ограничить употребление продуктов с данным веществом в составе людям с заболеваниями печени и ЖКТ. Такие продукты не советуют давать и детям младше 6-7 лет.
Работами Кольбе строение уксусной кислоты, а вместе с тем и всех других органических кислот было окончательно выяснено и роль последующих химиков свелась только к делению - в силу теоретических соображений и авторитета Жерара, формул Кольбе пополам и к переведению их на язык структурных воззрений, благодаря чему формула C2H6.C2O4H2 превратилась в CH3.CO(OH).
2. Свойства уксусной кислоты
Карбоновые кислоты - органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом.
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н. В водном растворе карбоновые кислоты диссоциируют на ионы:С увеличением молекулярной массы растворимость кислот в воде уменьшается. По числу карбоксильных групп кислоты подразделяются на одноосновные (монокарбоновые) и многоосновные (дикарбоновые, трикарбоновые и т.д.).
По характеру углеводородного радикала различают кислоты предельные, непредельные и ароматические.
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота . Часто используются также тривиальные названия.
Некоторые предельные одноосновные кислоты
|
Формула |
Название |
|
|
систематическое |
тривиальное |
|
|
метановая |
муравьиная |
|
|
этановая |
уксусная |
|
|
пропановая |
пропионовая |
|
|
бутановая |
масляная |
|
|
пентановая |
валерьяновая |
|
|
гексановая |
капроновая |
|
|
пентадекановая |
пальмитиновая |
|
|
гептадеканова |
стеариновая |
|
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные , т.е. соединения, полученные в результате реакций по карбоксильной группе.
2.1 Образование солей а) при взаимодействии с металлами:
2RCOOH + Mg ® (RCOO)2Mg + H2
б) в реакциях с гидроксидами металлов:
2RCOOH + NaOH ® RCOONa + H2O
Вместо карбоновых кислот чаще используют их галогенангидриды: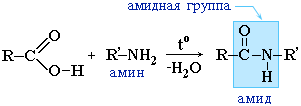 |
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из a-аминокислот с участием амидных групп - пептидных связей.
Уксусная (этановая кислота).
Формула: СН 3 – СООН; прозрачная бесцветная жидкость с резким запахом; ниже температуры плавления (т.пл. 16,6 градусов С) похожая на лед масса (поэтому концентрированную уксусную кислоту называют также ледяной уксусной кислотой). Растворима в воде, этаноле.
Таблица 1. Физические свойства уксусной кислоты
| Название | Формула кислоты |
Раство- римость (г/100мл H2O;25°C) | Ka (при 25°С) |
|||||
|
её соли (эфиры) |
||||||||
|
уксусная |
этановая | |||||||
Название:
Уксусная кислота (этановая кислота)- одноосновная карбоновая кислота алифатического ряда.
Химическая формула:
История открытия:
Уксусная кислота известна с древнейших времен, так как образуется при скисании вин (винный уксус).
Но строением уксусной кислоты и причиной возникновения, ученые заинтересовались лишь после сенсационного опубликования Дюма эмпирического правила замещения в органических соединениях водорода хлором. До этого в химии господствовала теория, выдвинутая Йенсом Якобом Берцелиусом. Он распределил элементы на электроположительные и электроотрицательные, и полностью отрицал замещения водорода и хлора соответственно, без изменения химического строения веществ.
В своей работе 1839 года Дюма для шведской академии представил отчет, в котором освятил начальные принципы, сформулированного им эмпирического правила для органических веществ, и для уксусной кислоты в частности: “В неорганической химии путеводной нитью нам служит изоморфизм, теория, основанная на фактах, как хорошо известно, мало согласных с электрохимическими теориями. В органической химии ту же роль играет теория замещения... и может быть будущее покажет, что оба воззрения более тесно связаны между собою, что они вытекают из одних и тех же причин и могут быть обобщены под одним и тем же названием.”
К такому заключению он шел несколько лет. Свои первые опыты Дюма начал с исследования уксусной кислоты, и превращения ее в хлоруксусную. Водород в этой реакции полностью замещается хлором, в соотношении 1:1, и самое главное без утраты основных химических свойств и отношения вещества к классу. Дальнейшие опыты с замещением водорода йодом и бромом окончательно убедили ученого в этом.
Революционным оказался вывод о принципиальном различии образования неорганических и органических соединений.
Однако, Берцелиус, защищая свою теорию, приводит пример щавелевой кислоты, и полученной соли при соединении ее с хлоридом, а значит утрате кислотных свойств. Он утверждает на примере как органических, так и неорганических соединениях что их кислородсодержащая часть может вступать в реакцию с основаниями и их лишаться, не теряя связи с хлорсодержащей частью. Именно этот аспект, по мнению химика, основное упущение, сделанное Дюма в своих опытах, т.к. он не опровергнул и не подтвердил этого известного факта.
Чтобы как-то объяснить, полученные Дюма результаты, Берцелиус выдвигает предположение: “хлоруксусная кислота Дюма,
очевидно, принадлежит к этому классу соединений; в ней радикал углерода соединен
и с кислородом, и с хлором. Она может быть, следовательно, щавелевой кислотою, в
которой половина кислорода замещена хлором, или же соединением 1 атома
(молекулы) щавелевой кислоты с 1 атомом (молекулой) полуторохлористого углерода
C2Cl6. Первое предположение не может быть принято, потому что оно допускает
возможность замещения хлором 11/2, атомов кислорода (По Берцелиусу щавелевая
кислота была C2O3.). Дюма же держится третьего представления, совершенно
несовместимого с двумя вышеизложенными, по которому хлор замещает не кислород, а
электроположительный водород, образуя углеводород C4Cl6, обладающий теми же
свойствами сложного радикала, как и C4H6 или ацетил, и способный якобы с 3
атомами кислорода давать кислоту, тожественную по свойствам с У., но, как видно
из сравнения (их физических свойств), вполне от нее отличную"
Но семена, заложенные Дюма, давали свои всходы. Теперь многие ученные отвернувшись от теории Берцелиуса продолжали нововведения. Так Шарль Фредерик Жерар впервые вопреки теории радикалов (создателем и приверженцем которой был Берцелиус) установил, что радикалы не существуют самостоятельно, а представляют собой атомные группы – “остатки”, комбинация которых образует молекулу. В своем очерке “Об основности кислот” в 1851 году он развил теорию типов, согласно которой все химические соединения можно классифицировать как производные четырех типов – водорода, хлороводорода, воды и аммиака. В частности была мысль об сходности конституции трихлоруксусной кислоты и уксусной кислоты. В свою защиту Берцелиус парирует: “Жерар высказал новый взгляд на состав спирта, эфира и их
производных; он следующий: известное соединение хрома, кислорода и хлора имеет
формулу = CrO2Cl2, хлор замещает в нем атом кислорода (Подразумевается
Берцелиусом 1 атом кислорода хромового ангидрида - CrO3). У. кислота C4H6+3O
заключает в себе 2 атома (молекулы) щавелевой кислоты, из которых в одном весь
кислород замещен водородом = C2O3+C2H6.” Но такая игра цифрами не удержала авторитета теории и год спустя Дюма наносит сокрушительный удар, развив теорию типов, исследуя сходные свойства трихлоруксусной кислоты и уксусной кислоты в реакции разложения, под влиянием щелочей.
С другой стороны, Либих и Греэм публично высказались за
большую простоту, достигаемую на почве теории замещения, при рассмотрении
хлоропроизводных обыкновенного эфира и эфиров муравьиной и У. кисл., полученных
Малагутти.
Берцелиус, уступая давлению новых фактов, в 5-м изд. своего
"Lehrbuch der Chemie" (Предисловие помечено ноябрем 1842 г.) , на стр. 709,
позабыв свой резкий отзыв о Жераре, нашел возможным написать следующее: "Если мы
припомним превращение (в тексте разложение) У. кислоты под влиянием хлора в
хлорощавелевую кислоту (Хлорощавелевой - Chloroxalsaure - Берцелиус называет
трихлоруксусную кисл. , то представляется
возможным еще другой взгляд на состав У. кислоты, а именно - она может быть сочетанной щавелевой кислотой, в которой сочетающейся группой (Paarling) является C2H6, подобно тому, как сочетающейся группой в хлорощавелевой кислоте является C2Cl6, и тогда действие хлора на У. кислоту состояло бы только в превращении C2H6 в C2Cl6. Понятно, нельзя решить, является ли такое представление более правильным..., однако, полезно обратить внимание на возможность его".
Но в полку сторонников теории типов все прибывало. Исходной точкой для работ Кольбе послужило изучение кристаллического вещества, состава CCl4SO2, полученного ранее Берцелиусом и Марсэ при действии царской водки на CS2 и образовавшегося у Кольбе при действии на CS2 влажного хлора. Рядом превращений Кольбе показал, что это
тело представляет, выражаясь современным языком, хлор ангидрид
трихлорометилсульфоновой кислоты, CCl4SO2 = CCl3.SO2Cl способный под влиянием щелочей давать соли соответственной кислоты - CCl3.SO2(OH), которая под влиянием цинка замещает сначала один атом Сl водородом, образуя кислоту CHCl2.SO2(OH) Гидратная вода, по обыкновению, Берцелиусом не принимается
во внимание.), а затем и другой, образуя кислоту CH2Cl.SO2(OH) [по Кольбе -
Chlorelaylunterschwefelsaure], а, наконец, при восстановлении током или калиевой
амальгамой (Реакция незадолго перед тем была применена Мельсансом для
восстановления трихлоруксусной кислоты в уксусную.) замещает водородом и все три
атома Сl, образуя метилсульфоновую кисл. CH3.SO2(OH) [по Кольбе -
Methylunterschwefelsaure].
Аналогия этих соединений с хлороуксусными кислотами
невольно бросалась в глаза; действительно, при тогдашних формулах получались два
параллельных ряда, как видно из следующей таблички: H2O+C2Cl6.S2O5
H2O+C2Cl6.C2O3 H2O+C2H2Cl4.S2O5 H2O+C2H2Cl4.C2O3 H2O+C2H4Cl2.S2O5
H2O+C2H4Cl2.C2O3 H2O+C2H6.S2O5 H2O+C2H6.C2O3 Это и не ускользнуло от Кольбе,
который замечает (I. с. стр. 181): "к описанным выше сочетанным сернистым
кислотам и непосредственно в хлороуглеродсернистой кислоте (выше -
H2O+C2Cl6.S2O5) примыкает хлорощавелевая кислота, известная еще под названием
хлоруксусной кислоты. Жидкий хлороуглерод - ССl (Сl=71, С=12; теперь мы пишем
C2Cl4 - это хлороэтилен.), как известно, превращается на свету под влиянием
хлора в - гексахлорэтан и можно ожидать, что, если бы его одновременно подвергнуть действию воды, то он, подобно хлористому висмуту, хлорной сурьме и т. д., в момент образования, заместит хлор кислородом. Опыт подтвердил предположение". При действии света и
хлора на C2Cl4, находившийся под водою, Кольбе получил на ряду с гексахлорэтаном
и трихлоруксусную кислоту и выразил превращение таким уравнением: (Так как С2Сl4
может быть получен из CCl4 при пропускании его через накаленную) трубку, а ССl4
образуется при действии, при нагревании, Cl2 на CS2 то реакция Кольбе была
первым по времени синтезом У. кислоты из элементов.) "Образуется ли одновременно
и свободная щавелевая кисл., трудно решить, так как на свету хлор тотчас же
окисляет ее в У. кислоту"...
Воззрение Берцелиуса на хлоруксусную кислоту
"удивительным образом (auf eine tiberraschende Weise) подтверждается
существованием и параллелизмом свойств сочетанных сернистых кислот, и, как мне
кажется (говорит Кольбе I. с. стр. 186), выходит из области гипотез и
приобретает высокую степень вероятности.
Его предвидение о дальнейших открытиях природы органических кислот подтверждается статьей, в которой он, опираясь на опыты пишет: “Не
невероятно, что мы будем принуждены в будущем принять за сочетанные кислоты
значительное число тех органических кислот, в которых в настоящее время, в силу
ограниченности наших сведений - мы принимаем гипотетическиe радикалы...".
Ему же свойственна теория радикалов, подтверждая уже ранее высказанное он также добавляет: "Что касается явлений замещения в этих сочетанных кисл., то они получают простое объяснение в том обстоятельстве, что различные, вероятно, изоморфные соединения способны замещать друг друга в роли сочетающихся групп не изменяя существенно кислых свойств сочетанного с ними тела!"
Дальнейшее экспериментальное подтверждение этого взгляда мы находим в статье Франкланда и Кольбе: “Исходя из представления, что все кислоты ряда
(CH2)2nO4, построены подобно метилщавелевой кислоте (Теперь мы пишем CnH2nO2 и
называем метилщавелевую кислоту – уксусной. Сочетанный в
муравьиной кислоте водород участвует в реакции только тем, что он, соединяясь с
цианом, образует синильную кислоту: Обратное образование муравьиной кислоты из
синильной под влиянием щелочей представляет не что иное, как повторение
известного превращения растворенного в воде циана в щавелевую кислоту и аммиак,
с тою лишь разницей; что в момент образования щавелевая кислота сочетается с
водородом синильной кислота ".
То, что цианистый бензол (С6H5CN), напр., по Фелингу, не обладает кислыми свойствами и не образует берлинской лазури может быть, по мнению Кольбе и Фанкланда, поставлено в параллель с неспособностью хлора хлористого этила к реакции с AgNO3, и правильность их наведения Кольбе и
Франкланд доказывают синтезом по методу нитрилов (Нитрилы ими получались
перегонкой серновинных кислот с KCN (методом Дюма и Малагутти с Лебланом):
R".SO3(OH)+KCN=R.CN+KHSO4) У., пропионовой (по тогдашнему, мет-ацетоновой,) и
капроновой кислоты.
Затем, в следующем году Кольбе подверг электролизу щелочные
соли одноосновных предельных кислот и, в согласии со своей схемой, наблюдал при
этом, при электролизе Уксусной кислоты, образование этана, угольной кислоты и
водорода:
H2O+C2H6.C2O3=H2+,
а при электролизе валериановой - октана, угольной же кислоты и водорода: H2O+C8H18.C2O3=H2+ .
Работами Кольбе строение уксусной кислоты, а вместе с тем и всех
других органических кислот было окончательно выяснено и роль последующих химиков
свелась только к делению - в силу теоретических соображений и авторитета Жерара,
формул Кольбе пополам и к переведению их на язык структурных воззрений,
благодаря чему формула C2H6.C2O4H2 превратилась в CH3.CO(OH).
Способы получения:
Основной технический метод получения уксусной кислоты – окисление ацетальдегида кислородом воздуха в присутствии марганцевых катализаторов.
ацетальдегид уксусная кислота
Химические свойства:
Взаимодействие с:
Металлами
Уксусная к-та Ацетат магния
Применение:
Уксусная кислота широко используется в промышленности для:
- Консервирования мясных и рыбных продуктов,
- Изготовления синтетического (ацетатного) волокна,
- Производства гербицидов,
- Синтеза душистых веществ и растворителей,
- В кожевенной, текстильной и других отраслях промышленности,
- Широко используется соли уксусной кислоты – ацетаты.
Курсовая работа
«Уксусная кислота»
Выполнил:_____________
______________________
Проверил:_____________
______________________
Волгоград 2004
Введение………………………………………………….3
1. Открытие уксусной кислоты……………………..5
2. Свойства уксусной кислоты……………………..13
3. Получение уксусной кислоты……………………19
4. Применение уксусной кислоты………………….22
Заключение……………………………………………....26
Список использованной литературы………………..…27
Введение
УКСУСНАЯ КИСЛОТА, CH3COOH, бесцветная горючая жидкость с резким запахом, хорошо растворимая в воде. Имеет характерный кислый вкус, проводит электрический ток.
Уксусная кислота была единственной, которую знали древние греки. Отсюда и ее название: "оксос" - кислое, кислый вкус. Уксусная кислота - это простейший вид органических кислот, которые являются неотъемлемой частью растительных и животных жиров. В небольших концентрациях она присутствует в продуктах питания и напитках и участвует в метаболических процессах при созревании фруктов. Уксусная кислота часто встречается в растениях, в выделениях животных. Соли и эфиры уксусной кислоты называются ацетатами.
Уксусная кислота - слабая (диссоциирует в водном растворе только частично). Тем не менее, поскольку кислотная среда подавляет жизнедеятельность микроорганизмов, уксусную кислоту используют при консервировании пищевых продуктов, например, в составе маринадов.
Получают уксусную кислоту окислением ацетальдегида и другими методами, пищевую уксусную кислоту уксуснокислым брожением этанола. Применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов. Уксусная кислота участвует во многих процессах обмена веществ в живых организмах. Это одна из летучих кислот, присутствующая почти во всех продуктах питания, кислая на вкус и главная составляющая уксуса.
Цель данной работы: изучить свойства, производство и применение уксусной кислоты.
Задачи данного исследования:
1. Рассказать об истории открытия уксусной кислоты
2. Изучить свойства уксусной кислоты
3. Описать способы получения уксусной кислоты
4. Раскрыть особенности применения уксусной кислоты
1. Открытие уксусной кислоты
Строение уксусной кислоты заинтересовало химиков со времени открытия Дюма трихлоруксусной кислоты, так как этим открытием был нанесен удар господствовавшей тогда электрохимической теории Берцелиуса. Последний, распределяя элементы на электроположительные и электроотрицательные, не признавал возможности замещения в органических веществах, без глубокого изменения их химических свойств, водорода (элемента электроположительного) хлором (элементом электроотрицательным), а между тем по наблюдениям Дюма ("Comptes rendus" Парижской академии, 1839) оказалось, что "введение хлора на место водорода не изменяет совершенно внешних свойств молекулы...", почему Дюма и задается вопросом "покоятся ли электрохимические воззрения и представления о полярности, приписываемой молекулам (атомам) простых тел, на столь ясных фактах, чтобы их можно было считать предметами безусловной веры; если же их должно рассматривать как гипотезы, то подходят ли эти гипотезы к фактам?... Должно признать, продолжает он, что дело обстоит иначе. В неорганической химии путеводной нитью нам служит изоморфизм, теория, основанная на фактах, как хорошо известно, мало согласных с электрохимическими теориями. В органической химии ту же роль играет теория замещения... и может быть будущее покажет, что оба воззрения более тесно связаны между собою, что они вытекают из одних и тех же причин и могут быть обобщены под одним и тем же названием. Пока же на основании превращения У. кислоты в хлоруксусную и альдегида в хлоральдегид (хлорал) и из того обстоятельства, что в этих случаях весь водород может быть замещен равным ему объемом хлора без изменения основного химического характера вещества, можно вывести заключение, что в органической химии существуют типы, которые сохраняются и тогда, когда на место водорода мы вводим равные объемы хлора, брома и йода. А это значит, что теория замещения покоится на фактах и при том наиболее блестящих в органической химии". Приводя эту выдержку в своем годовом отчете шведской академии ("Jahresbericht etc.", т. 19, 1840, стр. 370). Берцелиус замечает: "Дюма приготовил соединение, которому он придает рациональную формулу C4Cl6O3+H2O (Атомные веса современные; трихлоруксусная кислота рассматривается, как соединение ангидрида с водою.); это наблюдение он причисляет к faits les plus eclatants de la Chimie organique; это - основание его теории замещения. которая, по его мнению, опрокинет электрохимические теории..., а между тем оказывается, что стоит только его формулу написать несколько иначе, чтобы иметь соединение щавелевой кисл. с соответственным хлоридом, C2Cl6+C2O4H2, который остается соединенным со щавелевой кислотою и в кислоте, и в солях. Мы, следовательно, имеем дело с таким родом соединения, примеров которого известно много; многие... как простые, так и сложные радикалы обладают тем свойством, что их кислородсодержащая часть может вступать в соединение с основаниями и их лишаться, не теряя связи с хлорсодержащей частью. Это воззрение не приведено Дюма и не подвергнуто им опытной проверке, а между тем, если оно верно, то у нового учения, несовместимого, по Дюма, с господствовавшими до сих пор теоретическими представлениями, вырвана из под ног почва и оно должно пасть". Перечислив затем некоторые неорганические соединения, подобные, по его мнению, хлоруксусной кислоте (Между ними Берцелиусом приведен и хлор ангидрид хромовой кислоты - CrO2Cl2, который он считал за соединение надхлорного хрома (неизвестного и по сие время) с хромовым ангидридом: 3CrO2Cl2=CrCl6+2CrO3), Берцелиус продолжает: "хлоруксусная кислота Дюма, очевидно, принадлежит к этому классу соединений; в ней радикал углерода соединен и с кислородом, и с хлором. Она может быть, следовательно, щавелевой кислотою, в которой половина кислорода замещена хлором, или же соединением 1 атома (молекулы) щавелевой кислоты с 1 атомом (молекулой) полуторохлористого углерода - C2Cl6. Первое предположение не может быть принято, потому что оно допускает возможность замещения хлором 11/2, атомов кислорода (По Берцелиусу щавелевая кислота была C2O3.). Дюма же держится третьего представления, совершенно несовместимого с двумя вышеизложенными, по которому хлор замещает не кислород, а электроположительный водород, образуя углеводород C4Cl6, обладающий теми же свойствами сложного радикала, как и C4H6 или ацетил, и способный якобы с 3 атомами кислорода давать кислоту, тожественную по свойствам с У., но, как видно из сравнения (их физических свойств), вполне от нее отличную". Насколько Берцелиус в то время был глубоко убежден в различной конституции уксусной и трихлоруксусной кислоты, видно хорошо из замечания, высказанного им в том же году ("Jahresb.", 19, 1840, 558) по поводу статьи Жерара ("Journ. f. pr. Ch.", XIV, 17): "Жерар, говорит он, высказал новый взгляд на состав спирта, эфира и их производных; он следующий: известное соединение хрома, кислорода и хлора имеет формулу = CrO2Cl2, хлор замещает в нем атом кислорода (Подразумевается Берцелиусом 1 атом кислорода хромового ангидрида - CrO3). У. кислота C4H6+3O заключает в себе 2 атома (молекулы) щавелевой кислоты, из которых в одном весь кислород замещен водородом = C2O3+C2H6. И такой игрой в формулы заполнены 37 страниц. Но уже в следующем году Дюма, развивая далее идею типов, указал, что, говоря о тожестве свойств У. и трихлоруксусной кислоты, он подразумевал тожество их химических свойств, наглядно выражающееся, напр., в аналогии распадения их под влиянием щелочей: C2H3O2K + KOH = CH4 + K2CO8 и С2Cl3O2K + KOH = CHCl3 + K2CO8, так как CH4 и CHCl3 являются представителями одного и того же механического типа. С другой стороны, Либих и Греэм публично высказались за большую простоту, достигаемую на почве теории замещения, при рассмотрении хлоропроизводных обыкновенного эфира и эфиров муравьиной и У. кисл., полученных Малагутти, и Берцелиус, уступая давлению новых фактов, в 5-м изд. своего "Lehrbuch der Chemie" (Предисловие помечено ноябрем 1842 г.), позабыв свой резкий отзыв о Жераре, нашел возможным написать следующее: "Если мы припомним превращение (в тексте разложение) уксусной кислоты под влиянием хлора в хлорощавелевую кислоту (Хлорощавелевой - Chloroxalsaure - Берцелиус называет трихлоруксусную кисл. ("Lehrbuch", 5 изд., стр. 629).), то представляется возможным еще другой взгляд на состав уксусной кислоты (уксусная кислота называется Берцелиусом Acetylsaure.), а именно - она может быть сочетанной щавелевой кислотой, в которой сочетающейся группой (Paarling) является C2H6, подобно тому, как сочетающейся группой в хлорощавелевой кислоте является C2Cl6, и тогда действие хлора на уксусную кислоту состояло бы только в превращении C2H6 в C2Cl6. Понятно, нельзя решить, является ли такое представление более правильным..., однако, полезно обратить внимание на возможность его".
Таким образом, Берцелиусу пришлось допустить возможность замещения водорода хлором без изменения химической функции первоначального тела, в котором происходить замещение. Не останавливаясь на приложении его воззрений к другим соединениям, перехожу к работам Кольбе, который для уксусной кислоты, а затем и для других предельных одноосновных кислот нашел ряд фактов, гармонировавших со взглядами Берцелиуса (Жерара). Исходной точкой для работ Кольбе послужило изучение кристаллического вещества, состава CCl4SO2, полученного ранее Берцелиусом и Марсэ при действии царской водки на CS2 и образовавшегося у Кольбе при действии на CS2 влажного хлора. Рядом превращений Кольбе (См. Kolbe, "Beitrage znr Kenntniss der gepaarten Verbindungen" ("Ann. Ch. u. Ph.", 54, 1845, 145).) показал, что это тело представляет, выражаясь современным языком, хлор ангидрид трихлорометилсульфоновой кислоты, CCl4SO2 = CCl3.SO2Cl (Кольбе его назвал Schwefligsaures Kohlensuperchlorid), способный под влиянием щелочей давать соли соответственной кислоты - CCl3.SO2(OH) [по Кольбе НО + C2Cl3S2O5 - Chlorkohlenunterschwefelsaure] (Атомные веса: H=2, Cl=71, С=12 и О=16; а потому при современных атомных весах она - С4Сl6S2O6H2.) , которая под влиянием цинка замещает сначала один атом Сl водородом, образуя кислоту CHCl2.SO2(OH) [по Кольбе - wasserhaltige Chlorformylunterschwefelsaure (Берцелиус ("Jahresb. " 25, 1846, 91) замечает, что правильные считать ее сочетанием дитионовой кислоты S2O5 с хлороформилом, почему он CCl3SO2(OH) называет Kohlensuperchlorur (C2Cl6) - Dithionsaure (S2O5). Гидратная вода, по обыкновению, Берцелиусом не принимается во внимание.), а затем и другой, образуя кислоту CH2Cl.SO2(OH) [по Кольбе - Chlorelaylunterschwefelsaure], а, наконец, при восстановлении током или калиевой амальгамой (Реакция незадолго перед тем была применена Мельсансом для восстановления трихлоруксусной кислоты в уксусную.) замещает водородом и все три атома Сl, образуя метилсульфоновую кисл. CH3.SO2(OH) [по Кольбе - Methylunterschwefelsaure]. Аналогия этих соединений с хлороуксусными кислотами невольно бросалась в глаза; действительно, при тогдашних формулах получались два параллельных ряда, как видно из следующей таблички: H2O+C2Cl6.S2O5 H2O+C2Cl6.C2O3 H2O+C2H2Cl4.S2O5 H2O+C2H2Cl4.C2O3 H2O+C2H4Cl2.S2O5 H2O+C2H4Cl2.C2O3 H2O+C2H6.S2O5 H2O+C2H6.C2O3 Это и не ускользнуло от Кольбе, который замечает (I. с. стр. 181): "к описанным выше сочетанным сернистым кислотам и непосредственно в хлороуглеродсернистой кислоте (выше - H2O+C2Cl6.S2O5) примыкает хлорощавелевая кислота, известная еще под названием хлоруксусной кислоты. Жидкий хлороуглерод - ССl (Сl=71, С=12; теперь мы пишем C2Cl4 - это хлороэтилен.), как известно, превращается на свету под влиянием хлора в - гексахлорэтан (по тогдашней номенклатуре - Kohlensuperchlorur), и можно ожидать, что, если бы его одновременно подвергнуть действию воды, то он, подобно хлористому висмуту, хлорной сурьме и т. д., в момент образования, заместит хлор кислородом. Опыт подтвердил предположение". При действии света и хлора на C2Cl4, находившийся под водою, Кольбе получил на ряду с гексахлорэтаном и трихлоруксусную кислоту и выразил превращение таким уравнением: (Так как С2Сl4 может быть получен из CCl4 при пропускании его через накаленную) трубку, а ССl4 образуется при действии, при нагревании, Cl2 на CS2 то реакция Кольбе была первым по времени синтезом уксусной кислоты из элементов.) "Образуется ли одновременно и свободная щавелевая кисл., трудно решить, так как на свету хлор тотчас же окисляет ее в уксусную кислоту"... Воззрение Берцелиуса на хлоруксусную кислоту "удивительным образом (auf eine tiberraschende Weise) подтверждается существованием и параллелизмом свойств сочетанных сернистых кислот, и, как мне кажется (говорит Кольбе I. с. стр. 186), выходит из области гипотез и приобретает высокую степень вероятности. Ибо, если хлороуглещавелевая (Chlorkohlenoxalsaure так теперь Кольбе называет хлоруксусную кислоту.) имеет состав, подобный составу хлороуглесернистой кислоты, то мы должны считать и уксусную кислоту, отвечающую метилсернистой, за сочетанную кислоту и рассматривать ее, как метилщавелевую: C2H6.C2O3 (Это взгляд, высказанный ранее Жераром). Не невероятно, что мы будем принуждены в будущем принять за сочетанные кислоты значительное число тех органических кислот, в которых в настоящее время, в силу ограниченности наших сведений - мы принимаем гипотетическиe радикалы... " "Что касается явлений замещения в этих сочетанных кислот, то они получают простое объяснение в том обстоятельстве, что различные, вероятно, изоморфные соединения способны замещать друг друга в роли сочетающихся групп (als Раarlinge, l. с. стр. 187), не изменяя существенно кислых свойств сочетанного с ними тела!" Дальнейшее экспериментальное подтверждение этого взгляда мы находим в статье Франкланда и Кольбе: "Ueber die chemische Constitution der Sauren der Reihe (CH2)2nO4 und der unter den Namen "Nitrile" bekannten Verbindungen" ("Ann. Chem. n. Pharm. ", 65, 1848, 288). Исходя из представления, что все кислоты ряда (CH2)2nO4, построены подобно метилщавелевой кислоте (Теперь мы пишем CnH2nO2 и называем метилщавелевую кислоту - уксусной.), они замечают следующее: "если формула H2O+H2.C2O3 представляет истинное выражение рационального состава муравьиной кислоты, т. е. если ее считать за щавелевую кислоту, сочетанную с одним эквивалентом водорода (Выражение не верно; вместо Н гг. Франкланд и Кольбе употребляют перечеркнутую букву, которая равноценна 2 Н.), то без труда объясняется превращение при высокой температуре муравьинокислого аммония в водную синильную кислоту, потому что известно, и найдено еще Доберейнером, что щавелевокислый аммоний распадается при нагревании на воду и циан. Сочетанный в муравьиной кислоте водород участвует в реакции только тем, что он, соединяясь с цианом, образует синильную кислоту: Обратное образование муравьиной кислоты из синильной под влиянием щелочей представляет не что иное, как повторение известного превращения растворенного в воде циана в щавелевую кислоту и аммиак, с тою лишь разницей; что в момент образования щавелевая кислота сочетается с водородом синильной кислоты". То, что цианистый бензол (С6H5CN), например, по Фелингу, не обладает кислыми свойствами и не образует берлинской лазури может быть, по мнению Кольбе и Франкланда, поставлено в параллель с неспособностью хлора хлористого этила к реакции с AgNO3, и правильность их наведения Кольбе и Франкланд доказывают синтезом по методу нитрилов (Нитрилы ими получались перегонкой серновинных кислот с KCN (методом Дюма и Малагутти с Лебланом): R".SO3(OH)+KCN=R.CN+KHSO4) уксусной, пропионовой (по тогдашнему, мет-ацетоновой,) и капроновой кислоты, Затем, в следующем году Кольбе подверг электролизу щелочные соли одноосновных предельных кислот и, в согласии со своей схемой, наблюдал при этом, при электролизе уксусной кислоты, образование этана, угольной кислоты и водорода: H2O+C2H6.C2O3=H2+, а при электролизе валериановой - октана, угольной же кислоты и водорода: H2O+C8H18.C2O3=H2+ . Впрочем, нельзя не заметить, что Кольбе ожидал получить из уксусной кислоты метил (СН3)", соединенный с водородом, т. е. болотный газ, а из валериановой - бутил C4H9 , тоже соединенный с водородом, т. е. C4H10 (он называет C4H9 валлилом), но в этом ожидании надо видеть уступку получившим уже тогда значительные права гражданства формулам Жерара, который отказался от своего прежнего взгляда на уксусную кислоту и считал ее не за C4H8O4 каковой формулой, судя по криоскопическим данным, она обладает и на самом деле, а за C2H4O2 , как пишется во всех современных учебниках химии.




