Титан марки электрические свойства. Самый твердый металл в мире (Титан, Хром и Вольфрам)
Титан (Ti) (Titanium) - химический элемент с порядковым номером 22, атомный вес 47,88, легкий серебристо-белый металл. Плотность 4,51 г/см3, tпл.=1668+(-)5°С, tкип.=3260°С. Титан и титановые сплавы сочетают легкость, прочность, высокую коррозийную стойкость, низкий коэффициент теплового расширения, возможность работы в широком диапазоне температур.
Свойства титана
По внешнему виду титан похож на сталь. Титан относится к переходным элементам. Данный металл плавится при довольно высокой температуре (1668±4°С) и кипит при 3300 °С, скрытая теплота плавления и испарения титана почти в два раза больше, чем у железа.
По плотности и удельной теплоемкости титан занимает промежуточное место между двумя основными конструкционными металлами: алюминием и железом. Стоит также отметить, что его механическая прочность примерно вдвое больше, чем чистого железа, и почти в шесть раз выше, чем алюминия.
Титан имеет довольно высокое удельное электросопротивление, которое в зависимости от содержания примесей колеблется в пределах от 42 10-8 до 80 10-6 Ом см. При температурах ниже 0,45 К он становится сверхпроводником.
Титан - парамагнитный металл. У парамагнитных веществ магнитная восприимчивость при нагревании обычно уменьшается. Титан составляет исключение из этого правила - его восприимчивость существенно увеличивается с температурой.
Достоинства титана:
Малая плотность (4500 кг/м3), которая способствует уменьшению массы используемого материала;
-высокая механическая прочность. Важно то, что при повышенных температурах (250-500 °С) титановые сплавы по прочности превосходят высокопрочные сплавы алюминия и магния;
-очень высокая коррозионная стойкость, обусловленная способностью титана образовывать на поверхности тонкие (5-15 мкм) сплошные пленки оксида ТiO2, прочно связанные с массой металла;
-удельная прочность (отношение прочности и плотности) лучших титановых сплавов достигает 30-35 и более, что почти вдвое превышает удельную прочность легированных сталей.
Применение титана
Основная часть титана расходуется на нужды авиационной и ракетной техники и морского судостроения. Титан (ферротитан) используют в качестве лигирующей добавки к качественным сталям и как раскислитель. Технический титан идет на изготовление емкостей, химических реакторов, трубопроводов, арматуры, насосов, клапанов и других изделий, работающих в агрессивных средах. Из компактного титана изготавливают сетки и другие детали электровакуумных приборов, работающих при высоких температурах.
По использованию в качестве конструкционного материала титан находится на 4-ом месте, уступая лишь алюминию, железу и магнию. Алюминиды титана являются очень стойкими к окислению и жаропрочными, что в свою очередь определило их использование в авиации и автомобилестроении в качестве конструкционных материалов. Биологическая безвредность титана делает его превосходным материалом для пищевой промышленности и восстановительной хирургии.
Титан и его сплавы широко используются в технике ввиду своей высокой механической прочности, которая сохраняется при высоких температурах, коррозионной стойкости, жаропрочности, удельной прочности, малой плотности и прочих полезных свойств. Высокая стоимость титана и его сплавов во многих случаях компенсируется их большей работоспособностью, а в некоторых случаях они являются единственным материалом, из которого можно изготовить оборудование или конструкции, способные работать в данных конкретных условиях.
Титановые сплавы играют большую роль в авиационной технике, где стремятся получить наиболее легкую конструкцию в сочетании с необходимой прочностью. Титан легок по сравнению с другими металлами, но в то же время может работать при высоких температурах. Из титановых сплавов изготовляют обшивку, детали крепления, силовой набор, детали шасси, различные агрегаты. Также данные материалы применяются в конструкциях авиационных реактивных двигателей. Это позволяет уменьшить их массу на 10-25%. Из титановых сплавов производят диски и лопатки компрессора, детали воздухозаборника и направляющего аппарата, крепеж.
Также титан и его сплавы используют в ракетостроении. Ввиду кратковременной работы двигателей и быстрого прохождения плотных слоев атмосферы в ракетостроении в значительной мере снимаются проблемы усталостной прочности, статической выносливости и отчасти ползучести.
Свойства титана
В периодической системе элементов Менделеева титан имеет порядковый номер 22. Его нейтральный атом состоит из ядра, заряд которого равен 22 ед. положительного электричества, и находиться вне ядра 22 электронов.
Итак, ядро нейтрального атома титана содержит 22 протона. Количество же нейтронов, т. е. нейтральных незаряженных частиц, различно: чаще 26, но может колебаться от 24 до 28. Поэтому и число изотопов титана различно. Устойчивых природных изотопов титана всего пять: 46 Ti, 47 Ti, 48 Ti, 49 Ti, 50 Ti. Это установил в 1936 г. немецкий физик Ф. В. Астон. До его исследований считалось, что титан изотопов вообще не имеет. Природные устойчивые изотопы титана распределяются следующим образом (в отн. %): 46 Ti - 7,99; 47 Ti - 7,32; 48 Ti - 73,97; 49 Ti - 5,46; 50 Ti - 5,25.
Кроме естественных, титан может иметь и целый ряд искусственных изотопов, получаемых с помощью его радиоактивного облучения. Так, если бомбардировать титан нейтронами или α-частицами, можно получить радиоактивный изотоп титана 52 Ti с периодом полураспада - 41,9 мин, который дает β- и γ-излучения. Искусственно получены и другие изотопы титана (42 Ti, 43 Ti, 44 Ti, 45 Ti, 51 Ti, 52 Ti, 53 Ti, 54 Ti), некоторые из них сильнорадиоактивные, с различными сроками полураспада. Так, у изотопа 44 Ti период полураспада всего 0,58 с, а у изотопа 45 Ti - 47 лет.
Радиус ядра титана равен 5 фм. Вокруг положительно заряженного ядра титана на четырех орбитах К, L, М, N располагаются электроны: на К - два электрона, на L - восемь, на M - 10, на N - два. С орбит N и М атом титана может свободно отдавать по два электрона. Таким образом, наиболее устойчивый ион титана - четырехвалентный. Пятым электрон с орбиты М "вырвать" невозможно, поэтому титан никогда не бывает больше чем четырехвалентным ионом. В то же время с орбит N и М атом титана может отдавать не четыре, а три, два или один электрон. В этих случаях он становится трех-, двух- или одновалентным ионом
Титан различной валентности имеет неодинаковые ионные радиусы. Так, радиус иона Ti 4+ равен 64 пм, иона Ti 3+ - 69, Ti 2+ - 78, Ti 1+ - 95 пм.
Долгое время не могли точно определить атомную массу титана (атомный вес). В 1813 г. Й. Я. Берцелиус получил неправдоподобно завышенную величину - 288,16. В 1823 г. немецкий химик Генрих Розе установил, что атомный вес титана ранен 61,6. В 1829 г. ученый несколько раз уточнял величину: 50,63; 48,27 и 48,13. Ближе к истинным оказались измерения английского химика Т. Э. Торна - 48,09. Однако это значение продержалось до 1928 г., когда исследования химиков Бакстера и Бутлера дали окончательную величину атомного веса - 47,9. Атомная масса природного титана, вычисленная по результатам исследования его изотопов, составляет 47,926. Эта величина практически идентична значению интернациональных таблиц.
В периодической системе элементов Менделеева титан расположен в группе IVB, в которую, кроме него, входит цирконий, гафний, курчатовий. Элементы данной группы в отличие от элементов группы углерода (IVА) обладают металлическими свойствами. У соединений даже самого титана кислотообразующая способность выражена слабее, чем у любого элемента группы углерода. Хотя титан занимает самое верхнее место в своей подгруппе, он является наименее активным металлическим элементом. Так, двуокись титана амфотерна, а двуокиси циркония и гафния обладают слабо выраженными основными свойствами. Титан больше, чем другие элементы подгруппы IVB, близок к элементам подгруппы IVA - кремнию, германию, олову. Четырехвалентный титан отличается от кремния и германия большей склонностью к образованию комплексных соединений различных типов, чем особенно сходен с оловом.
Титан и другие элементы подгруппы IVB очень близки по свойствам к элементам подгруппы IIIB (группы скандия), хотя и отличаются от последних способностью проявлять большую валентность. Титан к скандию даже ближе, чем к элементам подгруппы IVA. Сходство титана со скандием, иттрием, а также с элементами подгруппы VВ - ванадием и ниобием выражается и в том, что в природных минералах титан часто встречается вместо с этими элементами, изоморфно замещая друг друга.
Из кристаллохимии кислородных соединений известно, что характерное координационное число для титана равно 6, а единственным координационным полиэдром, соответствующим этому числу, является октаэдр. Причем ни в одном из кислородных соединений атомы титана не имеют координационного числа больше 6. В такой координации среднее расстояние между титаном и кислородом равно 2 Å. В структурах, для которых характерно статистическое распределение атомов Ti 4+ и Nb 5+ в октаэдрах, соответствующее среднее расстояние между титаном и ниобием также составляет 2 Å. Из этого следует вывод о близости ионных радиусов титана и ниобия.
Близость ионных радиусов элементов - непременное условие возможности изоморфизма между ними. Для титана наиболее полно этому условию удовлетворяют ниобий, тантал, трехвалентное железо и цирконий.
А теперь рассмотрим, какие же химические соединении с другими элементами может образовывать титан. С одновалентными галогенами (фтором, бромом, хлором и йодом) он может образовывать ди-, три- и тетрасоединения, с серой и элементами её группы (селеном, теллуром) - моно- и дисульфиды, с кислородом - оксиды, диоксиды и триоксиды. Титан образует также соединения с водородом (гидриды), азотом (нитриды), углеродом (карбиды), фосфором (фосфиды), мышьяком (арсиды), а также соединения со многими металлами - интерметаллиды. Образует титан не только простые, но и многочисленные комплексные соединения, известно немало его соединений с органическими веществами.
Как видно из перечня соединений, в которых может участвовать титан, он химически весьма активен. И в то же время титан является одним из немногих металлов с исключительно высокой коррозионной стойкостью: он практически вечен в атмосфере воздуха, в холодной и кипящей воде, весьма стоек в морской воде, в растворах многих солей, неорганических и органических кислотах. По своей коррозионной стойкости в морской воде он превосходит все металлы, за исключением благородных - золота, платины и т. п., большинство видов нержавеющей стали, никелевые, медные и другие сплавы. В воде, во многих агрессивных средах чистый титан не подвержен коррозии. Почему же это происходит? Почему так активно, а нередко и бурно, со взрывами, реагирующий почти со всеми элементами периодической системы титан стоек к коррозии? А дело в том, что реакции титана со многими элементами происходят только при высоких температурах. При обычных температурах химическая активность титана чрезвычайно мала и он практически не вступает в реакции. Связано это с тем, что на свежей поверхности чистого титана, как только она образуется, очень быстро появляется инертная, хорошо срастающаяся с металлом тончайшая (в несколько ангстрем) пленка диоксида титана, предохраняющая его от дальнейшего окисления. Если даже эту шлепку снять, то в любой среде, содержащей кислород или другие сильные окислители (например, в азотной или хромовой кислоте), эта пленка появляется вновь, и металл, как говорят, ею "пассивируется", т. е. защищает сам себя от дальнейшего разрушения.
Известно, что коррозионная стойкость любого металла определяется величиной его электродного потенциала, т. е. разностью электрических потенциалов между металлом и раствором электролита. Отрицательные значения электродного потенциала свидетельствуют об убыли ионов металла с его поверхности и о переходе их в раствор, т. е. о растворимости и коррозии металла. Положительное значение указывает на то, что металл обладает стойкостью в данном растворе, не отдает своих ионов и не корродируется. Так вот, для свежеочищенной поверхности титана измеренные значения электродного потенциала в воде, в водных растворах, во многих кислотах и щелочах колеблются от -0,27 до -0,355 В, т. е. металл, казалось бы, должен быстро растворяться. Однако в большинство водных растворов электродный потенциал титана очень быстро поднимается от отрицательных до положительных значений, примерно до +0,5 В, и коррозия практически моментально прекращается: титан пассивируется и становится в высшей степени коррозионно-стойким.
Рассмотрим несколько подробнее поведение чистого титана в различных агрессивных средах. Об исключительной его стойкости в атмосфере, в пресной и океанической воде даже при нагревании мы уже говорили. Противостоит титан и эрозионной коррозии, происходящей в результате сочетания химического и механического воздействия на металл. В этом отношении он не уступает лучшим маркам нержавеющих сталей, сплавам на основе меди и другим конструкционным материалам. Хорошо противостоит титан и усталостной коррозии, проявляющейся часто в виде нарушений целостности к прочности металла (растрескивание, локальные очаги коррозии и т. п.). Поведение титана по многих агрессивных средах, в таких, как азотная, соляная, серная, "царская водка" и другие кислоты и щелочи, вызывает удивление и восхищение этим металлом.
В азотной кислоте, являющейся сильным окислителем, в котором быстро растворяются очень многие металлы, титан исключительно стоек. При любой концентрации азотной кислоты (от 10 до 99%-ной), при любых температурах скорость коррозии титана в азотной кислоте не превышает 0,1-0,2 мм/год. Опасна только красная дымящая азотная кислота, пересыщенная (20% и более) свободными диоксидами азота: в ней чистый титан бурно, со взрывом, реагирует. Однако стоит добавить в такую кислоту хотя бы немного воды (1- 2% и более), как реакция заканчивается, и коррозия титана прекращается.
В соляной кислоте титан стоек лишь в разбавленных ее растворах. Например, в 0,5%-ной соляной кислоте даже при нагревании до 100° С скорость коррозии титана не превышает 0,01 мм/год, в 10%-ной при комнатной температуре скорость коррозии достигает 0,1 мм/год, а в 20%-ной при 20° С - 0,58 мм/год. При нагревании скорость коррозии титана в соляной кислоте резко повышается. Так, даже в 1,5%-ной соляной кислоте при 100° С скорость коррозии титана составляет 4,4 мм/год, а в 20%-ной при нагревании до 60° С - уже 29,8 мм/год. Это объясняется тем, что соляная кислота, особенно при нагревании, растворяет пассивирующую пленку диоксида титана и начинается растворение металла. Однако скорость коррозии титана в соляной кислоте при всех условиях остается ниже, чем у нержавеющих сталей.
В серной кислоте слабой концентрации (до 0,5-1%) титан стоек даже при температуре раствора до 50 - 95° С. Стоек он и в более концентрированных растворах (10- 20%-ных) при комнатной температуре, в этих условиях скорость коррозии титана не превышает 0,005-0,01 мм/год. Но с повышением температуры раствора титан в серной кислоте даже сравнительно слабой концентрации (10-20%-ной) начинает растворяться, причем скорость коррозия достигает 9-10 мм/год. Серная кислота, так же как и соляная, разрушает защитную пленку диоксида титана и повышает его растворимость. Её можно резко понизить, если в растворы этих кислот добавлять определенное количество азотной, хромовой, марганцевой кислот, соединений хлора или других окислителей, которые быстро пассивируют поверхность титана защитной пленкой и прекращают его дальнейшее растворение. Вот почему титан практически единственный металл, не растворяющийся в "царской водке": в ней при обычных температурах (10-20° С) коррозия титана не превышает 0,005 мм/год. Слабо корродирует титан и в кипящей "царской водке", а ведь в ней, как известно, многие металлы, и даже такие, как золото, растворяются почти мгновенно.
Очень слабо корродирует титан в большинство органических кислот (уксусной, молочной, винной), и разбавленных щелочах, и растворах многих хлористых солей, в физиологическом растворе. А вот с расплавами хлоридов при температуре выше 375° С титан взаимодействует очень бурно.
В расплаве многих металлов чистый титан обнаруживает удивительную стойкость. В жидких горячих магнии, олове, галлии, ртути, литии, натрии, калии, в расплавленной сере титан практически не корродирует, и лишь при очень высоких температурах расплавов (выше 300-400° С) скорость его коррозии в них может достигать 1 мм/год. Однако есть немало агрессивных растворов и расплавов, в которых титан растворяется очень интенсивно. Главный "враг" титана - плавиковая кислота (HF). Даже в 1%-ном ее растворе скорость коррозии титана очень высока, а в более концентрированных растворах титан "тает", как лед в горячей воде. Фтор - этот "разрушающий всё" (греч.) элемент - бурно реагирует практически со всеми металлами и сжигает их.
Не может противостоять титан кремнефтористоводородной и фосфорной кислотам даже слабой концентрации, перекиси водорода, сухим хлору и брому, спиртам, в том числе спиртовой настойке йода, расплавленному цинку. Однако стойкость титана можно увеличить, если добавить различные окислители - так называемые ингибиторы, например, в растворы соляной и серной кислот - азотную и хромовую. Ингибиторами могут быть и ионы различных металлов в растворе: железо, медь и др.
В титан можно вводить некоторые металлы, повышающие его стойкость в десятки и сотни раз, например до 10% циркония, гафния, тантала, вольфрама. Введение в титан 20-30% молибдена делает этот сплав настолько устойчивым к любым концентрациям соляной, серной и других кислот, что он может заменить даже золото в работе с этими кислотами. Наибольший эффект достигается благодаря добавкам в титан четырех металлов платиновой группы: платины, палладия, родия и рутения. Достаточно всего 0,2% этих металлов, чтобы снизить скорость коррозии титана в кипящих концентрированных соляной и серной кислотах в десятки раз. Следует отметить, что благородные платиноиды влияют лишь на стойкость титана, а если добавлять их, скажем, в железо, алюминий, магний, разрушение и коррозия этих конструкционных металлов не уменьшаются.
Каковы же физические свойства титана, сделавшие его лучшим из всех, известных конструкционных металлов?
Титан весьма тугоплавкий металл. Долгое время, считалось, что он плавится при 1800° С, однако в середине 50-х гг. английские ученые Диардорф и Xeйc установили температуру плавления для чистого элементарного титана. Она составила 1668±3°C. По своей тугоплавкости титан уступает лишь таким металлам, как вольфрам, тантал, ниобий, ренин, молибден, платиноиды, цирконий, а среди основных конструкционных металлов он стоит на первом месте:
Важнейшей особенностью титана как металла являются его уникальные физико-химические свойства: низкая плотность, высокая прочность, твердость и др. Главное же, что эти свойства не меняются существенно при высоких температурах.
Титан - легкий металл, его плотность при 0° С составляет всего 4,517 г/см 3 , а при 100° С - 4,506 г/см 3 . Титан относится к группе металлов с удельной массой менее 5 г/см 3 . Сюда входят все щелочные металлы (натрий, калий, литий, рубидий, цезий) с удельной массой 0,9-1,5 г/см 3 , магний (1,7 г/см 3), алюминий (2,7 г/см 3) и др. Титан более чем в 1,5 раза тяжелее алюминия, и в этом он, конечно, ему проигрывает, но зато в 1,5 раза легче железа (7,8 г/см 3). Однако, занимая по удельной плотности промежуточное положение между алюминием и железом, титан по своим механическим свойствам во много раз превосходит и алюминий и железо.
Каковы же эти свойства, которые позволяют широко использовать титан как конструкционный материал? Прежде всего, прочность металла, т. е. его способность сопротивляться разрушению, а также необратимому изменению формы (пластические деформации). В зависимости от вида напряженного состояния - растяжения, сжатия, изгиба и других условий испытания (температура, время) для характеристики прочности металла используются различные показатели: предел текучести, временное сопротивление, предел усталости и др. По всем этим показателям титан значительно превосходит алюминий, железо и даже многие лучшие марки стали.
Удельная прочность сплавов титана может быть повышена в 1,5-2 раза. Его высокие механические свойства хорошо сохраняются при температурах вплоть до нескольких сот градусов. Другие же металлы либо просто не выдерживают таких температур, либо сильно разупрочняются.
Чистый титан - высокопластичный металл, что обусловлено благоприятным соотношением осей "с" и "а" в его гексагональной решетке и наличием в ней множества систем плоскостей скольжения и двойникования. Хотя и считается, что металлы с гексагональной кристаллической решеткой очень пластичны, титан в силу указанных особенностей его кристаллов стоит в одном ряду с высокопластичными металлами, имеющими иной тип кристаллической решетки. В результате чистый титан пригоден для любых видов обработки в горячем и холодном состоянии: его можно ковать, как железо, вытягивать и даже делать из него проволоку, прокатывать в листы, ленты, в фольгу толщиной до 0,01 мм.
Интересно отметить, что титан долгие годы, вплоть до получения чистого металла, рассматривали как очень хрупкий материал. Связано это было с наличием в титане примесей, особенно азота, кислорода, углерода и др. Даже их небольшое количество влияет, и весьма существенно, на свойства титана, в том числе на его пластичность. То же самое можно сказать и о твердости титана. Она тем выше, чем больше в металле примесей. Так, твердость титана, содержащего тысячные доли процента кислорода, азота, углерода, железа, составляет 400-600 МПа, а при содержания тех же примесей в сотые доли процента твердость его повышается до 900-1000 МПа.
Почему это происходит? Кислород и азот хорошо растворимы в титане, особенно в его низкотемпературной α-модификации. С их внедрением в октаэдрические пустоты кристаллов титана начинается деформация его кристаллической решетки, повышается жесткость межатомных связей и, как следствие, увеличивается твердость, прочность, предел текучести, снижается пластичность металла. Самой вредной примесью является водород: даже незначительные количества его резко снижают пластичность металла и особенно его ударную вязкость. Углерод растворяется в титане в гораздо меньшей степени и мало влияет на понижение пластичности металла. Железо ухудшает механические свойства титана, только если его содержится 0,5% и выше. Другие металлы почти не воздействуют на эти свойства.
Итак, чистый читан - это твердый, прочный, пластичный, достаточно вязкий и упругий металл. Твердость его по шкале Бринеля составляет около 1000 мн/м 2 . Для сравнения укажем, что железо имеет всего 350-450 мн/м 2 , медь - 350, магний литой - 294, магний деформированный - 353, а алюминий - всего 170 мн/м 2 . Модуль нормальной упругости титана 108 тыс. мн/м 2 , по упругости он лишь немного уступает меди и стали, но является более упругим, чем алюминий и магний.
Титан имеет высокий предел текучести - примерно 250 мн/м 2 . Это выше в 2,5 раза, чем у железа, в 3 раза, чем у меди, и почти в 20 раз, чем у алюминия. Следовательно, титан лучше этих металлов сопротивляется сминающим ударим и другим нагрузкам, способным деформировать титановые детали.
Высота и вязкость титана. Он отлично противостоит воздействию сколовых и сдвиговых ударов и нагрузок. Этой выносливостью объясняется еще одно замечательное свойство титана - исключительная стойкость его в условиях кавитации, т. е. при усиленной "бомбардировке" металла в жидкой среде пузырьками воздуха, которые образуются при быстром движении или вращении металлической детали в жидкой среде. Эти пузырьки воздуха, лопаясь на поверхности металла, вызывают очень сильные микроудары жидкости о поверхность движущегося тела. Они быстро разрушают многие материалы, и металлы в том числе, а вот титан прекрасно противостоит кавитации.
Испытания в морской воде быстровращающихся дисков из титана и других металлов показали, что при вращении в течение двух месяцев титановый диск практически не потерял в массе. Внешние края его, где скорость вращения, а, следовательно, и кавитация максимальны, не изменились. Другие диски не выдержали испытания: у всех внешние края оказались поврежденными, а многие из них вовсе разрушились.
Титан обладает еще одним удивительным свойством - "памятью". В сплаве с некоторыми металлами (например, с никелем) он "запоминает" форму изделия, которую из него сделали при определенной температуре. Если такое изделие потом деформировать, например, свернуть в пружину, изогнуть, то оно останется в таком положении на долгое время. После нагревания до той температуры, при которой это изделие было сделано, оно принимает первоначальную форму. Это свойство титана широко используется в космической технике (на корабле разворачиваются вынесенные в космическое пространство большие антенны, до этого компактно сложенные). Недавно это свойство титана стали использовать медики для бескровных операции на сосудах: в больной, суженный сосуд вводится проволочка из титанового сплава, а потом она, разогреваясь до температуры тела, скручивается в первоначальную пружинку и расширяет сосуд.
Заслуживают внимания температурные, электрические и магнитные свойства титана. Он обладает сравнительно низкой теплопроводностью, всего 22,07 Вт/(м К), что приблизительно в 3 раза ниже теплопроводности железа, в 7 раз - магния, в 17-20 раз - алюминия и меда. Соответственно и коэффициент линейного термического расширения у титана ниже, чем у других конструкционных металлов: при комнатной температуре (20° С) у титана он равен 8,5 10 -6 /°С, у железа - 11,7 10 -6 /°С, у меди- 17 10 -6 /°С, у алюминия - 23,9/°С. Сравнительно невелика и электропроводность титана. Объясняется, это свойство довольно высоким электрическим сопротивлением титана: при комнатной температуре оно составляет 42,1 10 -6 Ом см. С повышением температуры электросопротивление титана еще больше увеличивается, а с понижением ее резко надает, вблизи абсолютного нуля титан становится сверхпроводимым.
Титан - типичный парамагнетик, его магнитная восприимчивость при 20° С всего 3,2±0,4 10 -6 ед. Как известно, парамагнитными являются алюминий и магний, а вот медь диамагнитна, железо - ферромагнетик.
Мы рассмотрели химические и физические свойства титана, которые в целом благоприятствуют широкому использованию этого металла. Однако у титана есть немало и отрицательных качеств. Например, он может самовозгораться, а в некоторых случаях даже и взрываться.
Уже говорилось, что в концентрированной азотной кислоте титан исключительно стоек, а вот в красной дымящей, пересыщенной окислами азота, защитная пленка диоксида титана на поверхности металла моментально разрушается и чистый титан начинает реагировать с кислотой со взрывом. Такая реакция была причиной взрыва титановых топливных баков одной из американских космических ракет. Со взрывом реагирует титан и с сухим хлором. Есть способ предотвратить эти взрывные реакции. Стоит добавить в дымящую красную азотную кислоту всего 1-2% воды, а в сухой хлор и того меньше - 0,5-1%, и на поверхности металла тут же появится защитная пленка. Дальнейшее окисление титана предотвратится и взрыва не произойдет.
В виде тонкой стружки, опилок или порошка титан может самовозгораться даже без подвода тепла извне. Такие случаи наблюдались при его испытаниях на разрыв в атмосфере кислорода в момент разрыва. Это объясняется опять-таки высокой активностью свежей, неокисленной поверхности титана и сильной экзотермичностью реакции его взаимодействии с кислородом.
Титан может гореть не только в атмосфере кислорода, но даже в атмосфере азота, являющегося также сильным окислителем титана. Поэтому гасить горящий титан азотом, как и водой, углекислым газом, нельзя: они разлагаются, выделяя кислород, который затем взаимодействует с раскаленным титаном и дает взрыв.
Еще одним недостатком титана является его способность сохранять высокие физико-механические свойства лишь до температуры 400-450° С, а с добавками некоторых легирующих металлов - до 600° С, и здесь у него есть серьезные конкуренты - жаропрочные спецстали. Однако в минусовом диапазоне температур титану равных нет. Железо становится хрупким уже при температуре -40° С, специальные низкотемпературные стали - ниже -100° С. А вот титан и его сплавы не разрушаются при температурах до -253° С (в жидком водороде) и даже до -260° С (в жидком гелии). Это очень важное свойство титана открывает ему большие перспективы для использования в криогенной технике и для работы в космическом пространстве.
Титан реагирует со многими металлами. При трении с деталями из более мягкого металла титан может срывать с них металлические частицы и прилеплять к себе металл, а из более твердого, наоборот, частицы титана будут срываться с титановой детали и покрывать другую деталь. Причем никакая жировая или масляная смазка не помогает исключить взаимоналипание частиц. В течение небольшого времени это явление можно ослабить, лишь применив в качестве смазки чешуйчатые молибденит или графит. А вот сваривается титан с другими металлами очень плохо. Практически полностью эта проблема пока не решена, хотя сварка титановых изделий проходит отлично.
Титан - твердый металл, как мы уже знаем, тверже железа, алюминия, меди. Но все же не тверже специальных, особотвёрдых инструментальных сталей, из которых делают острые инструменты, ножи, скальпели. Здесь титан неприменим.
Титан - плохой проводник электричества и тепла. Проводов из него не сделаешь, а вот то, что он один из очень немногих металлов является при низких температурах сверхпроводником электричества, открывает ему большие перспективы в электрической технике передачи энергии на большие расстояния.
Титан - парамагнитный металл: он не намагничивается, как железо, в магнитном поле, но и не выталкивается из него, как медь. Его магнитная восприимчивость очень слаба, это свойства можно использовать при строительстве, например, немагнитных кораблей, приборов, аппаратов.
Итак, титан имеет больше достоинств, чем недостатков, и то, что он по иным характеристикам уступает некоторым специальным сталям и сплавам, компенсируется одним важнейшим обстоятельством. Легкость, прочность, пластичность, твердость, стойкость и многие другие качества соединены в одном металле так органично, что это сулит титану большое будущее.
Прежде чем рассказать, как используются титан, его сплавы и соединения сегодня и какие перспективы открываются перед этим металлом в недалеком завтра, рассмотрим подробно, как распространен этот удивительный металл в нашей Вселенной, на планете Земля, в каком виде встречается в породах земной коры, какие месторождения образует, как добываются, обогащаются руды, перерабатываются концентраты. Проследим долгий и нелегкий путь получения чистого титана, его обработки и использования человеком.
Все, что нужно знать о титане, а также о хроме и вольфраме
Многих интересует вопрос: какой самый твердый металл в мире? Это титан. Этому твердому веществу и будет посвящена большая часть статьи. Также немного ознакомимся и с такими твердыми металлами как хром и вольфрам.
9 интересных фактов о титане
1. Существует несколько версий, почему металл получил такое название. Согласно одной теории, его назвали в честь Титанов, бесстрашных сверхъестественных существ. По другой версии, название пошло от Титании, королевы фей.
2. Титан был открыт в конце XVIII века немецким и английским химиком.
3. Титан долго не использовали в промышленности из-за его природной хрупкости.
4. В начале 1925 года, после серии опытов, химики получили титан в чистом виде.
5. Стружка от титана легко воспламеняется.
6. Это один из самых легких металлов.
7. Титан может расплавиться только при температуре выше 3200 градусов.
8. Закипает при температуре 3300 градусов.
9. Титан имеет серебряный цвет.
История открытия титана
Металл, который впоследствии назвали титан, открыли двое ученых – англичанин Уильям Грегор и немец Мартин Грегор Клапрот. Ученые работали параллельно, и между собой не пересекались. Разница между открытиями составляет 6 лет.
Уильям Грегор дал своему открытию название — менакин.
Более чем через 30 лет был получен первый сплав титана, который оказался чрезвычайно хрупким, и не мог нигде использоваться. Считается, что лишь в 1925 году был выделен титан в чистом виде, который стал одним из самых востребованных в промышленности металлов.
Доказано, что российский ученый Кириллов в 1875 году сумел добыть чистый титан. Он опубликовал брошюру, в которой подробно описал свою работу. Однако исследования малоизвестного россиянина остались незамеченными.

Общая информация о титане
Титановые сплавы – спасение для механиков и инженеров. Например, корпус самолета изготовлен из титана. Во время полета он достигает скорости в несколько раз больше, чем скорость звука. Титановый корпус нагревается до температуры выше 300 градусов, и не плавится.
Металл замыкает десятку лидеров «Самых распространенных металлов в природе». Большие залежи обнаружены в ЮАР, Китае и , немало титана в Японии, Индии, на Украине.
Общее количество мирового запаса титанов насчитывает более 700 миллионов тонн. Если темпы добычи останутся прежними, титана хватит еще на 150-160 лет.
Крупнейший производитель самого твердого металла в мире – российское предприятие «ВСМПО-Ависма», которое удовлетворяет треть мировых потребностей.

Свойства титана
1. Коррозийная стойкость.
2. Высокая механическая прочность.
3. Небольшая плотность.
Атомный вес титана составляет 47, 88 а.е.м, порядковый номер в химической таблице Менделеева – 22. Внешне он очень похож на сталь.
Механическая плотность металла в 6 раз больше, чем у алюминия, в 2 раза выше, чем у железа. Он может соединиться с кислородом, водородом, азотом. В паре с углеродом металл образует невероятно твердые карбиды.
Теплопроводность титана в 4 раза меньше, чем у железа, и в 13 раз – чем у алюминия.


Процесс добычи титана
В земле титана большое количество, однако, извлечь его из недр стоит немалых денег. Для выработки используют иодидный метод, автором которого считается Ван Аркель де Бур.
В основе метода – способность металла сочетаться с иодом, после разложения этого соединения можно получить чистый, свободный от посторонних примесей титан.
Самые интересные вещи из титана:
- протезы в медицине;
- платы мобильных устройств;
- ракетные комплексы для освоения Космоса;
- трубопроводы, насосы;
- навесы, карнизы, наружная обшивка зданий;
- большинство деталей (шасси, обшивка).
Сферы применения титана
Титан активно используют в военной сфере, медицине, ювелирном деле. Ему дали неофициальное название «металл будущего». Многие говорят, что он помогает превратить мечту в реальность.
Самый твердый металл в мире изначально стали применять в военной и оборонной сфере. Сегодня основным потребителем титановых изделий является авиастроение.
Титан – универсальный конструкционный материал. Долгие годы он применялся для создания турбин самолетов. В авиационных двигателях из титана делают элементы вентилятора, компрессоры, диски.
Конструкция современного летательного аппарата может содержать до 20 тонн титанового сплава.
Основные сферы применения титана в авиастроении:
- продукция пространственной формы (окантовка дверей, люков, обшивка, настил пола);
- агрегаты и узлы, которые подвержены сильным нагрузкам (кронштейны крыльев, стойки шасси, гидроцилиндры);
- части двигателя (корпус, лопатки для компрессоров).
Благодаря титану человек смог пройти сквозь звуковой барьер, и ворваться в Космос. Его использовали для создания пилотируемых ракетных комплексов. Титан может выдержать космическую радиацию, перепады температур, скорость движения.
Этот металл имеет небольшую плотность, что важно в судостроительной сфере. Изделия из титана легкие, а значит, снижается вес , увеличивается его маневренность, скорость, дальность хода. Если корпус корабля обшить титаном, его не нужно будет красить много лет – титан не ржавеет в морской воде (коррозийная стойкость).
Чаще всего этот металл в судостроении используют для изготовления турбинных двигателей, паровых котлов, конденсаторных труб.

Нефтедобывающая отрасль и титан
Перспективной сферой использования сплавов из титана считается сверхглубокое бурение. Для изучения и добычи подземных богатств есть необходимость проникнуть глубоко под землю – свыше 15 тысяч метров. Буровые трубы из алюминия, например, разорвутся из-за собственной тяжести, и только сплавы из титана могут достигнуть действительно большой глубины.
Не так давно титан стал активно использоваться для создания скважин на морских шельфах. Специалисты применяют титановые сплавы в качестве оборудования:
- нефтедобывающие установки;
- сосуды высокого давления;
- глубоководные насосы, трубопроводы.

Титан в спорте, медицине
Титан крайне популярен в спортивной сфере из-за своей прочности и легкости. Несколько десятилетий назад из титановых сплавов сделали велосипед, первый спортивный инвентарь из самого твердого материала в мире. Современный велосипед состоит из титанового корпуса, такого же тормоза и пружин сидений.
В Японии создали титановые клюшки для игры в гольф. Эти приспособления легкие и долговечные, но крайне дорогие по цене.
Из титана делают большинство предметов, которые лежат в рюкзаке альпинистов и путешественников – столовая посуда, наборы для приготовления еды, стойки для укрепления палаток. Титановые ледорубы – очень востребованный спортивный инвентарь.
Этот металл очень востребован в медицинской отрасли. Из титана делают большинство хирургических инструментов – легких и удобных.
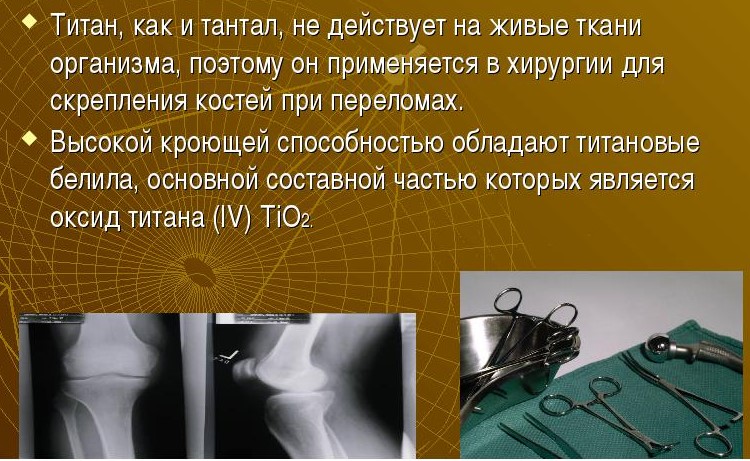
Еще одна сфера применения металла будущего – создание протезов. Титан превосходно «сочетается» с организмом человека. Медики назвали этот процесс «настоящее родство». Конструкции из титана безопасны для мышц и костей, редко вызывают аллергическую реакцию, не разрушаются под воздействием жидкости в организме. Протезы из титана стойкие, выдерживают огромные физические нагрузки.
Титан – удивительный металл. Он помогает человеку достичь невиданных высот в различных сферах жизни. Его любят и почитают за прочность, легкость и долгие годы службы.

Одним из самых твердых металлов является и хром
Интересные факты о хроме
1. Название металла происходит от греческого слова «chroma», что в переводе означает краска.
2. В естественной среде хром в чистом виде не встречается, а только в виде хромистого железняка, двойного оксида.
3. Самые большие месторождения металла расположены в ЮАР, России, Казахстане и Зимбабве.
4. Плотность металла – 7200кг/м3.
5. Хром плавится при температуре 1907 градусов.
6. Закипает при температуре 2671 градусов.
7. Совершенно чистый без примесей хром характеризуется тягучестью и вязкостью. В сочетании с кислородом, азотом или водородом металл становится ломким и очень твердым.
8. Этот металл серебристо-белого цвета открыл француз Луи Никола Воклен в конце XVIII века.

Свойства металла хрома
У хрома очень высокая твердость, им можно разрезать стекло. Он не окисляется воздухом, влагой. Если металл нагреть, окисление произойдет только на поверхности.
В год потребляют более 15 000 тон чистого хрома. Лидером по производству чистейшего хрома считается английская компания «Bell Metals».
Больше всего хрома потребляют в США, западных странах Европы и Японии. Рынок хрома нестабилен, и цены охватывают широкий диапазон.

Сферы использования хрома
Чаще всего применяется для создания сплавов и гальванических покрытий (хромирование на транспорт).
Хром добавляют в сталь, что улучшает физические свойства металла. Эти сплавы – наиболее востребованы в черной металлургии.
Сталь самой популярной марки состоит из хрома (18%) и никеля (8%). Такие сплавы отлично противостоят окислению, коррозии, прочны даже при высоких температурах.
Из стали, которая содержит треть хрома, изготавливают нагревательные печи.
Что еще делают из хрома?
1. Стволы огнестрельного оружия.
2. Корпус подводных лодок.
3. Кирпичи, которые используют в металлургии.

Еще одним чрезвычайно твердым металлом является вольфрам
Интересные факты о вольфраме
1. Название металла в переводе с немецкого («Wolf Rahm») означает «пена волка».
2. Это наиболее тугоплавкий металл в мире.
3. Вольфрам имеет светло-серый оттенок.
4. Металл был открыт в конце XVIII века (1781г) шведом Карлом Шееле.
5. Вольфрам плавится при температуре 3422 градусов, кипит – при 5900.
6. Металл имеет плотность 19.3 г/см³.
7. Атомная масса – 183.85, элемент VI группы в периодической системе Менделеева (порядковый номер – 74).

Процесс добычи вольфрама
Вольфрам относится к большой группе редких металлов. В нее входит также рубидий, молибден. Для этой группы характерна небольшая распространенность металлов в природе и малые масштабы потребления.
Получение вольфрама состоит из 3 этапов:
- отделение металла от руды, скапливание его в растворе;
- выделение соединения, его очистка;
- выделение чистого металла из готового химического соединения.
- Исходный материал для получения вольфрама – шеелит и вольфрамит.

Сферы применения вольфрама
Вольфрам является основой большинства прочных сплавов. Из него делают авиационные двигатели, детали электровакуумных приборов, нити накаливания.
Высокая плотность металла позволяет использовать вольфрам для создания баллистических ракет, пуль, противовесы, артиллерийские снаряды.
Соединения на основе вольфрама применяют для обработки других металлов, в горнодобывающей промышленности (бурение скважин), лакокрасочной, текстильной сфере (как катализатор органического синтеза).
Из сложных вольфрамовых соединений делают:
- проволоки – используются в нагревательных печах;
- ленты, фольгу, пластины, листы – для прокатки и плоской ковки.

Титан, хром и вольфрам возглавляют список «Самые твердые металлы в мире». Их используют во многих сферах деятельности человека – авиа и ракетостроении, военной области, строительстве, и при этом, это далеко не полный спектр применения металлов.
ОПРЕДЕЛЕНИЕ
Титан - двадцать второй элемент Периодической таблицы. Обозначение - Ti от латинского «titanium». Расположен в четвертом периоде, IVB группе. Относится к металлам. Заряд ядра равен 22.
Титан очень распространен в природе; содержание титана в земной коре составляет 0,6% (масс.), т.е. выше, чем содержание таких широко используемых в технике металлов, как медь, свинец и цинк.
В виде простого вещества титан представляет собой серебристо-белый металл (рис. 1). Относится к легким металлам. Тугоплавок. Плотность - 4,50 г/см 3 . Температуры плавления и кипения равны 1668 o С и 3330 o С, соответственно. Коррозионно-устойчив при на воздухе при обычной температуре, что объясняется наличием на его поверхности защитной пленки состава TiO 2 .
Рис. 1. Титан. Внешний вид.
Атомная и молекулярная масса титана
Относительной молекулярная масса вещества (M r) - это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (A r) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии титан существует в виде одноатомных молекул Ti, значения его атомной и молекулярной масс совпадают. Они равны 47,867.
Изотопы титана
Известно, что в природе титан может находиться в виде пяти стабильных изотопов 46 Ti, 47 Ti, 48 Ti, 49 Ti и 50 Ti. Их массовые числа равны 46, 47, 48, 49 и 50 соответственно. Ядро атома изотопа титана 46 Ti содержит двадцать два протона и двадцать четыре нейтрона, а остальные изотопы отличаются от него только числом нейтронов.
Существуют искусственные изотопы титана с массовыми числами от 38-ми до 64-х, среди которых наиболее стабильным является 44 Ti с периодом полураспада равным 60 лет, а также два ядерных изотопа.
Ионы титана
На внешнем энергетическом уровне атома титана имеется четыре электрона, которые являются валентными:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2 .
В результате химического взаимодействия титан отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Ti 0 -2e → Ti 2+ ;
Ti 0 -3e → Ti 3+ ;
Ti 0 -4e → Ti 4+ .
Молекула и атом титана
В свободном состоянии титан существует в виде одноатомных молекул Ti. Приведем некоторые свойства, характеризующие атом и молекулу титана:
Сплавы титана
Главное свойство титана, способствующее его широкому применению в современной технике - высокая жаростойкость как самого титана, так и его сплавов с алюминием и другими металлами. Кроме того, эти сплавы жаропрочностью - стойкостью сохранять высокие механические свойства при повышенных температурах. Все это делает сплавы титана весьма ценными материалами для самолето- и ракетостроения.
При высоких температурах титан соединяется с галогенами, кислородом, серой, азотом и другими элементами. На этом основано применение сплавов титана с железом (ферротиттана) в качестве добавки к стали.
Примеры решения задач
ПРИМЕР 1
ПРИМЕР 2
| Задание | Вычислите количество теплоты, выделяющейся при восстановлении хлорида титана (IV) массой 47,5 г магнием. Термохимическое уравнение реакции имеет следующий вид: |
| Решение | Запишем еще раз термохимическое уравнение реакции:
TiCl 4 + 2Mg = Ti + 2MgCl 2 =477 кДж. Согласно уравнению реакции, в неё вступили 1 моль хлорида титана (IV) и 2 моль магния. Рассчитаем массу хлорида титана (IV) по уравнению, т.е. теоретическую массу (молярная масса - 190 г/моль): m theor (TiCl 4) = n (TiCl 4) × M (TiCl 4); m theor (TiCl 4) = 1 × 190 = 190 г. Составим пропорцию: m prac (TiCl 4)/ m theor (TiCl 4) = Q prac /Q theor . Тогда, количество теплоты, выделяющейся при восстановлении хлорида титана (IV) магнием равно: Q prac = Q theor × m prac (TiCl 4)/ m theor ; Q prac = 477 × 47,5/ 190 = 119,25 кДж. |
| Ответ | Количество теплоты равно 119,25 кДж. |
Основная часть титана расходуется на нужды авиационной и ракетной техники и морского судостроения. Его, а также ферротитан используют как легирующую добавку к качественным сталям и как раскислитель. Технический титан идет на изготовление емкостей, химических реакторов, трубопроводов, арматуры, насосов, клапанов и других изделий, работающих в агрессивных средах. Из компактного титана изготавливают сетки и другие детали электровакуумных приборов, работающих при высоких температурах.
По использованию в качестве конструкционного материала Ti находится на 4-ом месте, уступая лишь Al, Fe и Mg. Алюминиды титана являются очень стойкими к окислению и жаропрочными, что в свою очередь определило их использование в авиации и автомобилестроении в качестве конструкционных материалов. Биологическая безвредность данного металла делает его превосходным материалом для пищевой промышленности и восстановительной хирургии.
Титан и его сплавы нашли широкое применение в технике ввиду своей высокой механической прочности, которая сохраняется при высоких температурах, коррозионной стойкости, жаропрочности, удельной прочности, малой плотности и прочих полезных свойств. Высокая стоимость данного металла и материалов на его основе во многих случаях компенсируется их большей работоспособностью, а в некоторых случаях они являются единственным сырьем, из которого можно изготовить оборудование или конструкции, способные работать в данных конкретных условиях.
Титановые сплавы играют большую роль в авиационной технике, где стремятся получить наиболее легкую конструкцию в сочетании с необходимой прочностью. Ti легок по сравнению с другими металлами, но в то же время может работать при высоких температурах. Из материалов на основе Ti изготавливают обшивку, детали крепления, силовой набор, детали шасси, различные агрегаты. Также данные материалы применяются в конструкциях авиационных реактивных двигателей. Это позволяет уменьшить их массу на 10-25%. Из титановых сплавов производят диски и лопатки компрессоров, детали воздухозаборников и направляющих в двигателях, различный крепеж.
Еще одной областью применения является ракетостроение. Ввиду кратковременной работы двигателей и быстрого прохождения плотных слоев атмосферы в ракетостроении в значительной мере снимаются проблемы усталостной прочности, статической выносливости и отчасти ползучести.
Технический титан из-за недостаточно высокой тепловой прочности не пригоден для применения в авиации, но благодаря исключительно высокому сопротивлению коррозии в ряде случаев незаменим в химической промышленности и судостроении. Так его применяют при изготовлении компрессоров и насосов для перекачки таких агрессивных сред, как серная и соляная кислота и их соли, трубопроводов, запорной арматуры, автоклав, различного рода емкостей, фильтров и т. п. Только Ti обладает коррозионной стойкостью в таких средах, как влажный хлор, водные и кислые растворы хлора, поэтому из данного металла изготовляют оборудование для хлорной промышленности. Также из него делают теплообменники, работающие в коррозионно активных средах, например в азотной кислоте (не дымящей). В судостроении титан используется для изготовления гребных винтов, обшивки морских судов, подводных лодок, торпед и т.д. На данный материал не налипают ракушки, которые резко повышают сопротивление судна при его движении.
Титановые сплавы перспективны для использования во многих других применениях, но их распространение в технике сдерживается высокой стоимостью и недостаточной распространенностью данного металла.
Соединения титана также получили широкое применение в различных отраслях промышленности. Карбид (TiC) обладает высокой твердостью и применяется в производстве режущих инструментов и абразивных материалов. Белый диоксид (TiO 2) используется в красках (например, титановые белила), а также при производстве бумаги и пластика. Титанорганические соединения (например, тетрабутоксититан) применяются в качестве катализатора и отвердителя в химической и лакокрасочной промышленности. Неорганические соединения Ti применяются в химической электронной, стекловолоконной промышленности в качестве добавки. Диборид (TiB 2)- важный компонент сверхтвердых материалов для обработки металлов. Нитрид (TiN) применяется для покрытия инструментов.




