Угольный ангидрид. Углекислый газ, Е290 — влияние на организм, вред и польза
Пищевая добавка Е290 (диоксид углерода) применяется в пищевой промышленности в роли консерванта, регулятора кислотности и антиоксиданта. В быту добавка Е290 больше известна, как углекислый газ.
По своим физическим свойствам диоксид углерода является бесцветным газом, не имеющим запаха и обладающим немного кисловатым вкусом. Добавка Е290 может растворяться в воде с образованием слабой угольной кислоты. Химическая формула диоксида углерода: CO 2 .
В промышленных масштабах углекислый газ получают из дымовых газов путем его абсорбирования карбонатом калия или моноэтаноламина. Для этого смесь промышленных газов пропускают через раствор карбоната калия. Диоксид углерода абсорбируется данным раствором, образуя гидрокарбонат. Далее раствор гидрокарбоната нагревают или подвергают пониженному давлению, в результате чего из него высвобождается чистая углекислота.
Кроме этого, диоксид углерода могут получать на специальных установках по разделению воздуха, как побочный продукт при добыче чистого кислорода, аргона и азота.
В небольших количествах в лабораторных условиях диоксид углерода получают путем взаимодействия карбонатов с кислотами. Например, в ходе реакции мела с соляной кислотой происходит образование нестабильной угольной кислоты с последующим ее распадом на углекислый газ и воду:
- СаСО 3 + 2НСl = СаСl 2 + СО 2 + Н 2 О
Диоксид углерода входит в состав атмосферы и многих живых клеток нашего организма. По этой причине добавку Е290 можно отнести к классу относительно безвредных пищевых добавок.
Однако, следует помнить, что углекислый газ способствует ускоренному всасыванию различных веществ в слизистую желудка. Именно этот эффект проявляется при быстром опьянении в результате употребления газированных алкогольных напитков.
Кроме этого, газированные напитки представляют собой не что иное, как слабую угольную кислоту. Поэтому чрезмерное употребление напитков с добавкой Е290 противопоказано людям с болезнями желудка и желудочно-кишечного тракта (язвы, гастриты).
Существуют и более безобидные «побочные эффекты» воздействия углекислоты на организм. Так, при употреблении газированных напитков, у большинства людей наблюдается отрыжка и «вздутие живота».
Бытует и еще одно мнение относительно вреда пищевой добавки Е290. Сильногазированные напитки могут способствовать «вымыванию» кальция из костей организма.
В пищевой промышленности диоксид углерода применяется в качестве добавки-консерванта Е290 при производстве алкогольных и безалкогольных напитков. Угольная кислота, образуемая при реакции диоксида углерода с водой обладает обеззараживающим и антимикробным действием.
В хлебопекарном деле добавка Е290 может применяться в качестве разрыхлителя, придавая пышность хлебобулочным изделиям.
Диоксид углерода широко применяется и при производстве винной продукции. Регулируя количество углекислого газа в вином сусле можно управлять брожением.
Также оксид углерода может применяться в роли защитного газа при хранении и транспортировки различных пищевых продуктов.
Другие направления использования диоксида углерода:
- в сварочном производстве в качестве защитной атмосферы;
- в холодильных установках в виде «сухого льда»;
- в системах пожаротушения
- в газобалонной пневматике
Добавка Е290 разрешена для использования в пищевой промышленности практически всех стран мира, в том числе Украине и РФ.
Газировка, вулкан, Венера, рефрижератор – что между ними общего? Углекислый газ. Мы собрали для Вас самую интересную информацию об одном из самых важных химических соединений на Земле.
Что такое диоксид углерода
Диоксид углерода известен в основном в своем газообразном состоянии, т.е. в качестве углекислого газа с простой химической формулой CO2. В таком виде он существует в нормальных условиях – при атмосферном давлении и «обычных» температурах. Но при повышенном давлении, свыше 5 850 кПа (таково, например, давление на морской глубине около 600 м), этот газ превращается в жидкость. А при сильном охлаждении (минус 78,5°С) он кристаллизуется и становится так называемым сухим льдом, который широко используется в торговле для хранения замороженных продуктов в рефрижераторах.
Жидкая углекислота и сухой лед получаются и применяются в человеческой деятельности, но эти формы неустойчивы и легко распадаются.
А вот газообразный диоксид углерода распространен повсюду: он выделяется в процессе дыхания животных и растений и является важной составляющей частью химического состава атмосферы и океана.
Свойства углекислого газа
Углекислый газ CO2 не имеет цвета и запаха. В обычных условиях он не имеет и вкуса. Однако при вдыхании высоких концентраций диоксида углерода можно почувствовать во рту кисловатый привкус, вызванный тем, что углекислый газ растворяется на слизистых и в слюне, образуя слабый раствор угольной кислоты.
Кстати, именно способность диоксида углерода растворяться в воде используется для изготовления газированных вод. Пузырьки лимонада – тот самый углекислый газ. Первый аппарат для насыщения воды CO2 был изобретен еще в 1770 г., а уже в 1783 г. предприимчивый швейцарец Якоб Швепп начал промышленное производство газировки (торговая марка Schweppes существует до сих пор).
Углекислый газ тяжелее воздуха в 1,5 раза, поэтому имеет тенденцию «оседать» в его нижних слоях, если помещение плохо вентилируется. Известен эффект «собачьей пещеры», где CO2 выделяется прямо из земли и накапливается на высоте около полуметра. Взрослый человек, попадая в такую пещеру, на высоте своего роста не ощущает избытка углекислого газа, а вот собаки оказываются прямо в густом слое диоксида углерода и подвергаются отравлению.
CO2 не поддерживает горение, поэтому его используют в огнетушителях и системах пожаротушения. Фокус с тушением горящей свечки содержимым якобы пустого стакана (а на самом деле — углекислым газом) основан именно на этом свойстве диоксида углерода.
Углекислый газ в природе: естественные источники
Углекислый газ в природе образуется из различных источников:
- Дыхание животных и растений.
Каждому школьнику известно, что растения поглощают углекислый газ CO2 из воздуха и используют его в процессах фотосинтеза. Некоторые хозяйки пытаются обилием комнатных растений искупить недостатки приточной вентиляции. Однако растения не только поглощают, но и выделяют углекислый газ в отсутствие света – это часть процесса дыхания. Поэтому джунгли в плохо проветриваемой спальне – не очень хорошая идея: ночью уровень CO2 будет расти еще больше. - Вулканическая деятельность.
Диоксид углерода входит в состав вулканических газов. В местностях с высокой вулканической активностью CO2 может выделяться прямо из земли – из трещин и разломов, называемых мофетами. Концентрация углекислого газа в долинах с мофетами столь высока, что многие мелкие животные, попав туда, умирают. - Разложение органических веществ.
Углекислый газ образуется при горении и гниении органики. Объемные природные выбросы диоксида углерода сопутствуют лесным пожарам.
Углекислый газ «хранится» в природе в виде углеродных соединений в полезных ископаемых: угле, нефти, торфе, известняке. Гигантские запасы CO2 содержатся в растворенном виде в мировом океане.

Выброс углекислого газа из открытого водоема может привести к лимнологической катастрофе, как это случалось, например, в 1984 и 1986 гг. в озерах Манун и Ньос в Камеруне. Оба озера образовались на месте вулканических кратеров – ныне они потухли, однако в глубине вулканическая магма все еще выделяет углекислый газ, который поднимается к водам озер и растворяется в них. В результате ряда климатических и геологических процессов концентрация углекислоты в водах превысила критическое значение. В атмосферу было выброшено огромное количество углекислого газа, который наподобие лавины спустился по горным склонам. Жертвами лимнологических катастроф на камерунских озерах стали около 1 800 человек.
Искусственные источники углекислого газа
Основными антропогенными источниками диоксида углерода являются:
- промышленные выбросы, связанные с процессами сгорания;
- автомобильный транспорт.
Несмотря на то, что доля экологичного транспорта в мире растет, подавляющая часть населения планеты еще не скоро будет иметь возможность (или желание) перейти на новые автомобили.
Активное сведение лесов в промышленных целях также ведет к повышению концентрации углекислого газа СО2 в воздухе.
CO2 – один из конечных продуктов метаболизма (расщепления глюкозы и жиров). Он выделяется в тканях и переносится при помощи гемоглобина к легким, через которые выдыхается. В выдыхаемом человеком воздухе около 4,5% диоксида углерода (45 000 ppm) – в 60-110 раз больше, чем во вдыхаемом.
Углекислый газ играет большую роль в регуляции кровоснабжения и дыхания. Повышение уровня CO2 в крови приводит к тому, что капилляры расширяются, пропуская большее количество крови, которое доставляет к тканям кислород и выводит углекислоту.

Дыхательная система тоже стимулируется повышением содержания углекислого газа, а не нехваткой кислорода, как может показаться. В действительности нехватка кислорода долго не ощущается организмом и вполне возможна ситуация, когда в разреженном воздухе человек потеряет сознание раньше, чем почувствует нехватку воздуха. Стимулирующее свойство CO2 используется в аппаратах искусственного дыхания: там углекислый газ подмешивается к кислороду, чтобы «запустить» дыхательную систему.
Углекислый газ и мы: чем опасен СO2
Углекислый газ необходим человеческому организму так же, как кислород. Но так же, как с кислородом, переизбыток углекислого газа вредит нашему самочувствию.
Большая концентрация CO2 в воздухе приводит к интоксикации организма и вызывает состояние гиперкапнии. При гиперкапнии человек испытывает трудности с дыханием, тошноту, головную боль и может даже потерять сознание. Если содержание углекислого газа не снижается, то далее наступает черед – кислородного голодания. Дело в том, что и углекислый газ, и кислород перемещаются по организму на одном и том же «транспорте» – гемоглобине. В норме они «путешествуют» вместе, прикрепляясь к разным местам молекулы гемоглобина. Однако повышенная концентрация углекислого газа в крови понижает способность кислорода связываться с гемоглобином. Количество кислорода в крови уменьшается и наступает гипоксия.
Такие нездоровые для организма последствия наступают при вдыхании воздуха с содержанием CO2 больше 5 000 ppm (таким может быть воздух в шахтах, например). Справедливости ради, в обычной жизни мы практически не сталкиваемся с таким воздухом. Однако и намного меньшая концентрация диоксида углерода отражается на здоровье не лучшим образом.
Согласно выводам некоторых , уже 1 000 ppm CO2 вызывает у половины испытуемых утомление и головную боль. Духоту и дискомфорт многие люди начинают ощущать еще раньше. При дальнейшем повышении концентрации углекислого газа до 1 500 – 2 500 ppm критически , мозг «ленится» проявлять инициативу, обрабатывать информацию и принимать решения.
И если уровень 5 000 ppm почти невозможен в повседневной жизни, то 1 000 и даже 2 500 ppm легко могут быть частью реальности современного человека. Наш показал, что в редко проветриваемых школьных классах уровень CO2 значительную часть времени держится на отметке выше 1 500 ppm, а иногда подскакивает выше 2 000 ppm. Есть все основания предполагать, что во многих офисах и даже квартирах ситуация похожая.
Безопасным для самочувствия человека уровнем углекислого газа физиологи считают 800 ppm.
Вы уже знаете, что при выдохе из легких выходит углекислый газ. А вот что вам известно об этом веществе? Наверное, немного. Сегодня я отвечу на все вопросы, касающиеся углекислого газа.
Определение
Это вещество в нормальных условиях является бесцветным газом. Во многих источниках его могут называть по-разному: и оксидом углерода (IV), и угольным ангидридом, и двуокисью углерода, и диоксидом углерода.
Свойства
Углекислый газ (формула СО 2) является бесцветным газом, имеющим кислые запах и вкус, растворимым в воде веществом. Если его как следует охладить, то образуется снегообразная масса, называемая сухим льдом (фотография ниже), которая сублимирует при температуре -78 о С.  Является одним из продуктов гниения или горения любого органического вещества. Растворяется в воде только при температуре 15 о С и только в том случае, если отношение вода:углекислый газ равно 1:1. Плотность углекислого газа может быть разной, но в стандартных условиях она равняется 1,976 кг/м 3 . Это если он находится в газообразном виде, а в других состояниях (жидком/газообразном) значения плотности тоже будут другими. Данное вещество является кислотным оксидом, его добавление в воду приводит к получению угольной кислоты. Если соединить углекислый газ с любой щелочью, то в результате последующей реакции образуются карбонаты и гидрокарбонаты. Этот оксид не может поддерживать горение, кроме некоторых исключений. Это активные металлы, и при реакции такого вида они забирают у него кислород.
Является одним из продуктов гниения или горения любого органического вещества. Растворяется в воде только при температуре 15 о С и только в том случае, если отношение вода:углекислый газ равно 1:1. Плотность углекислого газа может быть разной, но в стандартных условиях она равняется 1,976 кг/м 3 . Это если он находится в газообразном виде, а в других состояниях (жидком/газообразном) значения плотности тоже будут другими. Данное вещество является кислотным оксидом, его добавление в воду приводит к получению угольной кислоты. Если соединить углекислый газ с любой щелочью, то в результате последующей реакции образуются карбонаты и гидрокарбонаты. Этот оксид не может поддерживать горение, кроме некоторых исключений. Это активные металлы, и при реакции такого вида они забирают у него кислород.
Получение
Углекислый и еще некоторые газы в больших количествах выделяются, когда производят алкоголь или разлагаются природные карбонаты. Затем полученные газы проходят промывание растворенным карбонатом калия. Далее следует поглощение ими углекислого газа, продуктом данной реакции является гидрокарбонат, при нагревании раствора которого получают искомый оксид.  Но сейчас его с успехом заменяет растворенный водой этаноламин, который абсорбирует содержащийся в дымовом газе оксид углерода и отдает его при нагревании. Также этот газ является побочным продуктом тех реакций, при которых получают чистые азот, кислород и аргон. В лаборатории немного углекислоты получается, когда карбонаты и гидрокарбонаты взаимодействуют с кислотами. Еще она образуется, когда реагируют пищевая сода и лимонный сок или тот же гидрокарбонат натрия и уксус (фото).
Но сейчас его с успехом заменяет растворенный водой этаноламин, который абсорбирует содержащийся в дымовом газе оксид углерода и отдает его при нагревании. Также этот газ является побочным продуктом тех реакций, при которых получают чистые азот, кислород и аргон. В лаборатории немного углекислоты получается, когда карбонаты и гидрокарбонаты взаимодействуют с кислотами. Еще она образуется, когда реагируют пищевая сода и лимонный сок или тот же гидрокарбонат натрия и уксус (фото).
Применение
Пищевая промышленность не может обойтись без использования углекислоты, где она известна в качестве консерванта и разрыхлителя, имеющего код E290. Ее в виде жидкости содержит любой огнетушитель.  Также оксид четырехвалентного углерода, который выделяется в процессе брожения, служит хорошей подкормкой аквариумным растениям. Он содержится и во всем известной газировке, которую многие довольно часто покупают в продуктовом магазине. Сварка проволокой происходит в углекислой среде, но если температура данного процесса очень высока, то он сопровождается диссоциацией углекислоты, при которой выделяется кислород, окисляющий металл. Тогда сварка не обходится без раскислителей (марганца или кремния). Углекислым газом накачивают велосипедные колеса, он присутствует и в баллончиках пневматического оружия (такая его разновидность называется газобаллонной). Также данный оксид в твердом состоянии, называемый сухим льдом, нужен как хладагент в торговле, научных исследованиях и при починке некоторой техники.
Также оксид четырехвалентного углерода, который выделяется в процессе брожения, служит хорошей подкормкой аквариумным растениям. Он содержится и во всем известной газировке, которую многие довольно часто покупают в продуктовом магазине. Сварка проволокой происходит в углекислой среде, но если температура данного процесса очень высока, то он сопровождается диссоциацией углекислоты, при которой выделяется кислород, окисляющий металл. Тогда сварка не обходится без раскислителей (марганца или кремния). Углекислым газом накачивают велосипедные колеса, он присутствует и в баллончиках пневматического оружия (такая его разновидность называется газобаллонной). Также данный оксид в твердом состоянии, называемый сухим льдом, нужен как хладагент в торговле, научных исследованиях и при починке некоторой техники.
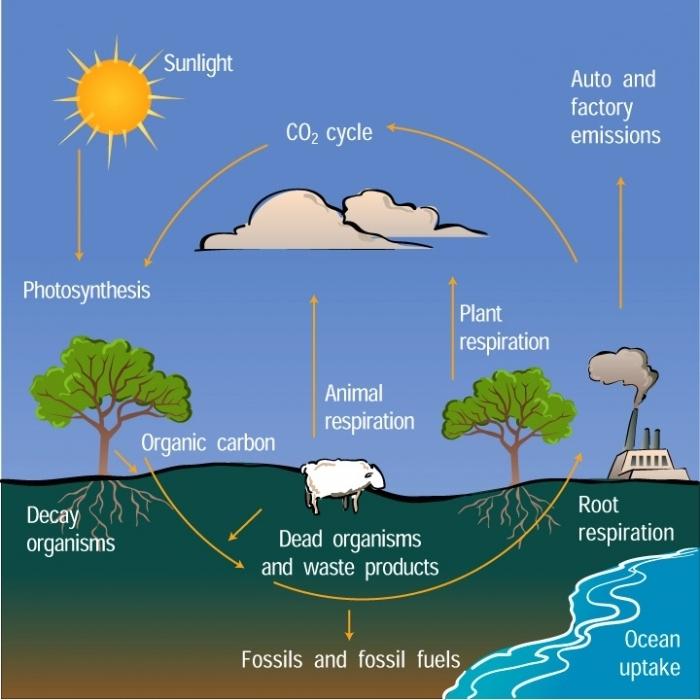 Заключение
Заключение
Вот до чего полезен для человека углекислый газ. И не только в промышленности, он играет и важную биологическую роль: без него не может происходить газообмен, регуляция сосудистого тонуса, фотосинтез и многие другие природные процессы. Но его переизбыток или недостача в воздухе некоторое время могут негативно влиять на физическое состояние всех живых организмов.
В ней равна +4), называется диоксид углерода (иные названия: углекислый газ, ангидрид угольной кислоты, двуокись углерода). Это вещество принято записывать молекулярной формулой CO2. Молярная масса его равна 44,01 г/моль. По внешнему виду при нормальных условиях угольный ангидрид является бесцветным газом. При низких концентрациях он не имеет запаха, при более высоких концентрациях приобретает острый, кислый запах.
Для этого химического вещества возможны три агрегатных состояния, которые характеризуются различными значениями плотности:
- твердое (сухой лед); при давлении 1 атм. и температуре -78,5 °С — 1562 кг/м³;
- жидкое (углекислота); при давлении 56 атм. и температуре +20 °С — 770 кг/м³;
- газообразное; при давлении 1 атм. и температуре 0 °С — 1,977 кг/м³.
Температура плавления двуокиси углерода равняется -78 °С, температура кипения— -57 °С. Вещество растворяется в воде: при 25 °С и давлении 100 кПа его растворимость равняется 1,45 г/л.
Диоксид углерода является естественным химическим соединением, в молекуле которого атомы кислорода с атомом углерода связаны ковалентной связью. Молекула углекислого газа является линейной и центросимметричной. Обе связи между углеродом и двумя кислородными атомами эквивалентны (по сути являются двойными). Молекула симметрична относительно своего центра, поэтому она не имеет никакого электрического дипольного момента.
Диоксид углерода был одним из первых газообразных химических соединений, которые перестали отождествлять с воздухом. В семнадцатом веке фламандский химик Ян Баптиста ван Гельмонт заметил, что, когда он сжигается уголь в закрытом сосуде, масса полученной золы намного меньше, чем у обычного Свойства двуокиси углерода были изучены более тщательно в 1750 году шотландским врачом Джозефом Блэком.
Диоксид углерода при стандартном давлении и температуре находится в атмосфере Земли в количестве примерно 0,04 % объемных. В рамках углеродного цикла, известного как фотосинтез, двуокись углерода поглощается растениями, водорослями, цианобактериями. В результате образуется вода и углеводы, но происходит этот процесс только под действием света. Углекислый газ также образуется при сжигании угля или углеводородов, при ферментации жидкостей и при выдыхании воздуха людьми и животными. Кроме того, выбрасывается из вулканов, горячих источников, гейзеров.
В диоксид углерода играет важную роль (поглощает и испускает излучение в тепловом инфракрасном диапазоне). Также это химическое соединение является одним из основных источников снижения рН океана: растворяясь в воде, оно образует слабую угольную кислоту: CO2 + H2O ↔ H2CO3, неспособную полностью диссоциировать на ионы.
Углекислый газ не поддерживает горения и дыхания. Зажженная лучина в его атмосфере гаснет. Животные и человек при большой концентрации CO2 задыхаются. При 3 %-ной концентрации в воздухе учащается дыхание, при 10 %-ной наступает потеря сознания и быстрая смерть, а 20 %-ное содержание вызывает мгновенный паралич.
Диоксид углерода является ангидридом угольной кислоты, поэтому для него характерны свойства кислотного оксида. В лабораторных условиях его получают при взаимодействии мела с соляной кислотой в CaCO3 + 2HCl → CaCl2 + CO2 + H2O. В промышленности его производят термическим разложением известняка или мела (реже магнезита или доломита): CaCO3 → CaO + CO2. Получение углекислоты является побочным процессом низкотемпературного разделения воздуха на азот и кислород. В наше время выпускаются специальные генераторы для получения углекислого газа из воздуха. Применяются такие генераторы для подачи CO2 в теплицы с целью создания благоприятной среды для растений.
Диоксид углерода имеет широкое применение в химических производствах. Его используют для получения соды, для синтеза органических кислот, для изготовления безалкогольных напитков. используется как холодильный агент, например, в виноделии. Углекислотная атмосфера создается для предотвращения гниения пищевых продуктов, того же винограда после его сбора и до начала производства вина.
Производство углекислоты или сжиженного углекислого газа осуществляется для заполнения им которые используются для тушения возгораний. Однако им нельзя тушить человека, так значительная часть струи жидкого CO2 испаряется, при этом температура резко понижается (что может вызвать обморожение) и CO2 превращается в сухой лед. Углекислотой обычно тушат легковоспламеняющиеся жидкости и электропроводку. Механизм заключается в прекращении поступления доступа кислорода воздуха к очагу возгорания.
Углекислый газ - вещество, которое имеет множество названий: оксид углерода (IV), диоксид углерода или же двуокись углерода. Также его еще называют угольным ангидридом. Он является совершенно бесцветным газом, который не имеет запаха, с кисловатым вкусом. Углекислый газ тяжелее воздуха и плохо растворяется в воде. При температуре ниже - 78 градусов Цельсия кристаллизуется и становится похожим на снег.
Из газообразного состояния это вещество переходит в твердое, поскольку не может существовать в жидком состоянии в условиях атмосферного давления. Плотность углекислого газа в нормальных условиях составляет 1,97 кг/м3 - в 1,5 раза выше Диоксид углерода в твердом виде называется «сухой лед». В жидкое состояние, в котором его можно хранить длительное время, он переходит при повышении давления. Рассмотрим подробнее данное вещество и его химическое строение.
Углекислый газ, формула которого CO2, состоит из углерода и кислорода, а получается он в результате сжигания или гниения органических веществ. Оксид углерода содержится в воздухе и подземных минеральных источниках. Люди и животные тоже выделяют углекислый газ при выдыхании воздуха. Растения без освещения выделяют его, а во время фотосинтеза интенсивно поглощают. Благодаря процессу метаболизма клеток всех живых существ оксид углерода является одним из главных составляющих окружающей природы.
Этот газ не токсичен, но если он скапливается в большой концентрации, может начаться удушье (гиперкапния), а при его недостатке развивается противоположное состояние - гипокапния. Диоксид углерода пропускает и отражает инфракрасные. Он является парниковым газом, который непосредственно влияет на глобальное потепление. Это происходит из-за того, что уровень его содержания в атмосфере постоянно растет, что и приводит к парниковому эффекту.
Диоксид углерода получают промышленным путем из дымных или печных газов, или же путем разложения карбонатов доломита и известняка. Смесь этих газов тщательно промывается специальным раствором, состоящим из Далее она переходит в гидрокарбонат и при нагревании разлагается, в результате чего высвобождается углекислота. Углекислота (H2CO3) образуется из углекислого газа, растворенного в воде, но в современных условиях получают ее и другими, более прогрессивными методами. После того как углекислый газ очищен, его сжимают, охлаждают и закачивают в баллоны.
В промышленности это вещество широко и повсеместно применяется. Пищевики используют его как разрыхлитель (например, для приготовления теста) или в качестве консерванта (Е290). С помощью углекислого газа производят различные тонизирующие напитки и газировки, которые так любимы не только детьми, но и взрослыми. Диоксид углерода используют при изготовлении пищевой соды, пива, сахара, шипучих вин.
Углекислый газ применяется и при производстве эффективных огнетушителей. С помощью углекислого газа создается активная среда, необходимая при При высокой температуре сварочной дуги углекислый газ распадается на кислород и угарный газ. Кислород взаимодействует с жидким металлом и окисляет его. Углекислота в баллончиках применяется в пневматических ружьях и пистолетах.
Авиамоделисты используют это вещество в качестве топлива для своих моделей. С помощью углекислого газа можно значительно повысить урожайность культур, выращиваемых в оранжерее. Также в промышленности широко используется в котором продукты питания сохраняются значительно лучше. Его применяют в качестве хладагента в холодильниках, морозильных камерах, электрических генераторах и других теплоэнергетических установках.




