الماء: تركيبه ، تركيبته الجزيئية ، خواصه الفيزيائية. الخواص الكيميائية للماء
يمكن تحديد تكوين الماء باستخدام تفاعل التحلل صدمة كهربائية. يتكون حجمان من الهيدروجين لكل حجم واحد من الأكسجين (حجم الغاز يتناسب مع كمية المادة):
2H 2 O \ u003d 2H 2 + O 2
يتكون الماء من جزيئات. يحتوي كل جزيء على ذرتين من الهيدروجين مرتبطة بروابط تساهمية مع ذرة أكسجين واحدة. الزاوية بين السندات حوالي 105 درجة:
أوه
ح
نظرًا لأن الأكسجين عنصر كهرسلبي أكثر (عامل مؤكسد قوي) ، فإن زوج الإلكترون الشائع للرابطة التساهمية ينتقل إلى ذرة الأكسجين ، وتتشكل شحنة سالبة جزئية δ− عليه ، وتتشكل شحنة موجبة جزئية δ + على ذرات الهيدروجين. تنجذب الجزيئات المجاورة لبعضها البعض عن طريق الشحنات المعاكسة - وهذا يسبب نسبيًا درجة حرارة عاليةماء مغلي.
الماء في درجة حرارة الغرفة- عديم اللون السائل واضح. نقطة الانصهار 0 درجة مئوية ، نقطة الغليان عند الضغط الجوي - 100 درجة مئوية. الماء النقي لا يوصل الكهرباء.
ميزة مثيرة للاهتمام للمياه هي أنها تحتوي على أعلى كثافة تبلغ 1 جم / سم 3 عند درجة حرارة حوالي 4 درجات مئوية. مع انخفاض درجة الحرارة بشكل أكبر ، تقل كثافة الماء. لذلك ، مع بداية فصل الشتاء ، تصبح طبقات الماء المتجمدة العلوية أخف وزنا ولا تغرق. يتشكل الجليد على السطح. عادة لا يحدث تجميد لقاع الخزان (إلى جانب ذلك ، يكون للثلج أيضًا كثافة مياه اقلوتطفو على السطح).
الخواص الكيميائية:
الملوثات الرئيسية المياه الطبيعيةتشمل مياه الصرف الصحي من المنشآت الصناعية التي تحتوي على مركبات الزئبق والزرنيخ والعناصر السامة الأخرى. قد تحتوي النفايات السائلة من مجمعات الثروة الحيوانية والمدن على نفايات تسبب التطور السريع للبكتيريا. يتمثل الخطر الكبير على المسطحات المائية الطبيعية في التخزين غير المناسب (الذي لا يوفر الحماية من هطول الأمطار في الغلاف الجوي) أو استخدام الأسمدة والمبيدات الحشرية التي يتم غسلها في المسطحات المائية. يؤدي النقل ، وخاصة المياه ، إلى تلويث المسطحات المائية بمنتجات النفط والمخلفات المنزلية التي يلقيها أشخاص عديمو الضمير في الماء مباشرة.
لحماية المياه ، من الضروري إدخال إمدادات المياه المغلقة للمؤسسات الصناعية ، والمعالجة المعقدة للمواد الخام والنفايات ، وبناء مرافق المعالجة ، التربية البيئيةتعداد السكان.
* تستخدم المحاليل الملحية في التحليل الكهربائي للماء
2. الخبرة. التعرف على ملح حمض الكربونيك بين الأملاح الثلاثة المقترحة.
التفاعل النوعي للكربونات هو التفاعل مع الأحماض ، مصحوبًا بإطلاق سريع لثاني أكسيد الكربون:
CaCO 3 + 2HCl \ u003d CaCl 2 + H 2 O + CO 2
أو في شكل أيوني:
CO 3 2− + 2H + = H 2 O + CO 2
من الممكن إثبات أن أول أكسيد الكربون (IV) يتم إطلاقه عن طريق تمريره عبر محلول من الماء الجير ، مما يجعله غائمًا:
CO 2 + Ca (OH) 2 \ u003d CaCO 3 ↓ + H 2 O
للتعرف على ملح حمض الكربونيك ، أضف القليل من الحمض إلى جميع أنابيب الاختبار الثلاثة (بحيث لا يفيض عند "الغليان"). حيثما يتم إطلاق غاز عديم اللون والرائحة ، توجد كربونات.
تحتل المياه مكانة خاصة بين الموارد الطبيعية للأرض - لا يمكن الاستغناء عنها. سوف تنفد مخزونات المعادن - ربما يمكن استبدالها بالبلاستيك ؛ لن يكون هناك ما يكفي من البروتينات النباتية والحيوانية - سوف يتعلمون كيفية الحصول على البروتينات الاصطناعية ؛ حتى بدلاً من الهواء العادي ، يكون المزيج الاصطناعي من الغازات مناسبًا في بعض الحالات. ستكون هناك حاجة للمياه في جميع الأعمار وأينما وجدت أشكال الحياة الأرضية.
والد الجيولوجيا الروسية والسوفيتية ، الأكاديمي أ.ب. كتب كاربينسكي أنه لا توجد أحفورة أثمن من الماء ، والتي بدونها لا يمكن لأحد أن يعيش. في ضوء ذلك ، ليس فقط لأغراض الاستكشاف الجيولوجي الخاصة ، ولكن بشكل خاص للحياة ، للزراعة ، لكل شيء ، الماء هو الأحفوري الأكثر أهمية.
أكبر مستهلك للمياه في العالم هو الزراعة والصناعة والطاقة في المرتبة الثانية ، والمرافق الحضرية في المرتبة الثالثة.
يتم استخدام كمية هائلة من المياه من أنهارنا وخزاناتنا للري. يتم إرجاع جزء من المياه التي يتم توفيرها للري عن طريق الجريان السطحي والجوفي إلى الشبكة الهيدروغرافية أو البحر. استهلاك المياه غير القابل للإلغاء هو الأكثر مؤشر مهمالتغيرات في الموارد المائية تحت تأثير الري. في جميع أنحاء البلاد ، تمثل المياه العائدة 40٪ من سحب المياه ، واستهلاك المياه غير القابلة للإرجاع - 60٪.
قيمة الماء في الإنتاج الكيميائي وتكنولوجيا HP.
الماء له أهمية عظيمةفي الإنتاج الكيميائي وتكنولوجيا الأدوية. درسنا هذه القيمة على مثال مؤسستين:
OJSC "Grodno Azot" ؛
شركة ذات مسؤولية محدودة "Pharmtechnologiya"
تعد الصناعات الكيميائية والصيدلانية من بين أكبر مستهلكي المياه. يستخدم الماء في جميع الصناعات الكيميائية والصيدلانية تقريبًا لأغراض متنوعة. يتم تفسير هذا الاستخدام للمياه من خلال بعض الخصائص:
وجود مجمع خصائص قيمة(سعة حرارية عالية ، لزوجة منخفضة ، نقطة غليان منخفضة ، إلخ) ؛
التوافر والتكلفة المنخفضة (تكاليف الاستخراج والتنقية فقط) ؛
غير سمية.
سهولة الاستخدام في الإنتاج والنقل.
الماء في الصناعة الكيميائية
في الصناعة الكيميائية ، تستخدم المياه في المجالات التالية:
1. للأغراض التكنولوجية مثل:
مذيب للمواد الصلبة والسائلة والغازية ؛
بيئات تنفيذ العمليات الفيزيائية والميكانيكية (التعويم ، ونقل المواد الصلبة في شكل لب ، وما إلى ذلك) ؛
سائل الغسيل للغازات
مستخلص و ماص للمواد المختلفة.
2. كحامل حراري (على شكل ماء ساخن وبخار) ومبرد لـ معدات التدفئة والتبريد.
3. كمادة خام وكاشف لإنتاج مواد كيميائية مختلفة منتجات (مثل الأمونيا والميثانول وحمض الكبريتيك والزيت ، حمض النيتريكوالأسمدة النيتروجينية السائلة ، إلخ. .) .
في الآونة الأخيرة ، تم تحديد مهمة مهمة للمؤسسات الصناعية - لتقليل استهلاك المياه العذبة من خلال تطوير إمدادات المياه المتداولة.
في الإنتاج ، الأكثر استهلاكًا للمياه هي: الكيماويات ، ولب الورق والورق ، والصناعات المعدنية ، والأغذية ، ومستحضرات التجميل ، والإلكترونيات الدقيقة ، إلخ.
السبب الرئيسي لتلوث أحواض المياه هو تصريف المياه العادمة غير المعالجة أو المعالجة بشكل غير كاف إلى المسطحات المائية من قبل المؤسسات الصناعية والمرافق والزراعة.
في مؤسسات الصناعة الكيميائية ، بما في ذلك Grodno Azot JSC ، يتم استخدام الماء في التكنولوجيا لإنتاج الأمونيا التقنية السائلة والأسمدة النيتروجينية (اليوريا وخليط اليوريا والأمونيا - UAN وكبريتات الأمونيوم وماء الأمونيا) وكابرولاكتام ؛ لتبريد المعدات ، لإنتاج البخار. ترتبط عمليات التآكل بالسمات المميزة للماء والمعادن. بسبب تآكل المبادلات الحرارية ، يتلوث الماء بشدة بالمنتجات التكنولوجية لإمدادات المياه المتداولة.
يتم تنقية المياه الطبيعية بعدة طرق:
من الجسيمات الكبيرة غير المذابة المعلقة ، يتم تنقية الماء عن طريق الترشيح. تمتلئ المرشحات الضخمة بطبقة سميكة من الرمل والحصى.
تتم إزالة الأملاح الذائبة كيميائيا.
من المعلقات الرقيقة التي تعطي اللون للماء ، تخلص من أملاح الألمنيوم:
3Ca (OH) 2 + Al 2 (SO 4) 3 \ u003d 2Al (OH) 3 ↓ + 2CaSO 4 ؛ (5)
3Na 2 CO 3 + Al 2 (SO 4) 3 + 3H 2 O \ u003d 2Al (OH) 3 ↓ + 3Na 2 SO 4 + 3CO 2. (6)
يلتقط الراسب اللزج لهيدروكسيد الألومنيوم معلقًا جيدًا من الماء ، وكذلك البكتيريا.
بعد أن يقف الماء في خزانات ترسيب ضخمة ، حيث تستقر جميع المواد غير المذابة ، يتم تطهيرها عن طريق عمل الكلور أو الأوزون أو الأشعة فوق البنفسجية.
تدخل المياه النقية تمامًا إلى شبكة إمدادات المياه. للمختبرات والمؤسسات العلمية ، وأكثر من ذلك ماء نقي. يتم تحقيق درجة عالية من التنقية عن طريق تقطير الماء - هذه هي الطريقة التي يتم بها الحصول على الماء المقطر.
للتنقية ، يتم استخدام الراتنجات الاصطناعية أيضًا - المبادلات الأيونية ، التي يتم من خلالها إطلاق الماء من الكاتيونات والأنيونات.
في أنظمة إمدادات المياه المتداولة ، لوحظ تآكل شديد للمعادن ، والذي يتم تدميره بسبب التفاعل الفيزيائي والكيميائي.
تبقى الأملاح الذائبة من الماء المتبخر في الماء الدائر ، مما يزيد من تركيزها. تسمى درجة الزيادة في تركيز المواد المذابة (غير متطايرة ولا تشكل راسبًا) معامل التركيز أو معامل التبخر
تتم معالجة مياه الصرف الصحي في مؤسسة JSC "Grodno Azot" في قسم معالجة النتروجين (NDF) والمعالجة اللاحقة في قسم المعالجة البيولوجية (BHO).
عديم الرائحة والمذاق وعديم اللون.
التوزيع في الطبيعة.- أحد أكثر المركبات شيوعًا على وجه الأرض. وجدت في الفضاء بين النجوم. جزء من المذنبات ، معظم الكواكب النظام الشمسيورفاقهم. تقدر الكمية الموجودة على سطح الأرض بـ 1.39 * 10 18 طن ، معظمتوجد في البحار والمحيطات. يبلغ عدد المياه العذبة المتاحة للاستخدام في الأنهار والبحيرات والمستنقعات والخزانات 2 * 10 4 أطنان. تبلغ كتلة الأنهار الجليدية في أنتاركتيكا والقارة القطبية الجنوبية والمناطق الجبلية العالية 2.4 * 10 16 طنًا ، وهناك نفس العدد تقريبًا من تحت الأرض الأنهار الجليدية ، وجزء صغير منها فقط طازج. تحتوي الطبقات العميقة للأرض على أكثر بكثير (على ما يبدو ، ليس أقل من ترتيب من حيث الحجم) مما هو على السطح. يبلغ حجم B حوالي 1.3 * 10 13 طن. مدرج في كثير والصخور (الصلصال ، إلخ) الموجودة في التربة ، هي مكون أساسي لجميع الكائنات الحية.
تكوين النظائر.هناك 9 أنواع مستقرة من النظائر. محتواها في المياه العذبة في المتوسط هو التالي (٪ مول): 1 H 2 16 O - 99.13 ؛ 1 H 2 18 O - 0.2 ؛ 1 H 2 17 0-0.04 ؛ 1 H 2 O 16 O-0.03 ؛ الأنواع الخمسة المتبقية من النظائر موجودة بكميات ضئيلة. بالإضافة إلى أصناف النظائر المستقرة ، فإنه يحتوي على كمية صغيرة من المشعة 3 H 2 (أو T 2 O). يختلف التركيب النظائري للطبيعي من أصل مختلف إلى حد ما. النسبة 1 H / 2 H غير مستقرة بشكل خاص: في المياه العذبة - في المتوسط 6900 ، في البحر - 5500 ، في الجليد - 5500-9000. حسب الفيزيائية خصائص D 2 O تختلف بشكل ملحوظ عن المعتاد. ، التي تحتوي على 18 O ، أقرب في خصائصها إلى 16 O.
هيكل الجزيء و الخصائص الفيزيائية. وتقع في الزوايا مثلث متساوي الساقينبطول رابطة O-H يبلغ 0.0957 نانومتر ؛ H-O-H 104.5 درجة ؛ 6.17 * 10-30 درجة مئوية * م ؛ 1.45 * 10 -3 نانومتر 3 ؛ المتوسط - 1.87 * 10 -41 درجة مئوية * م 2 ، طاقة التأين 12.6 فولت ، تقارب 7.1 فولت. عند التفاعل مع الآخرين ، بما في ذلك الآخرين في مراحل مكثفة ، تتغير هذه المعلمات.
بعض المعلمات التي تميز الخصائص في حالات التجميع المختلفة في أجهزة الصراف الآلي. ، أدناه (انظر أيضًا الجدول 1 والشكل 1 ، اللذين يوضحان مناطق وجود تعديلات الجليد المختلفة):
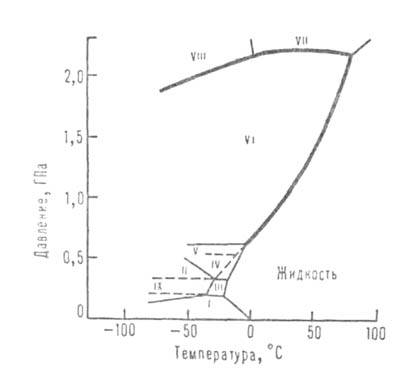
التفاعل بين جزيئات الماء. هيكل المراحل المكثفة.، وجود لحظة ثنائية القطب كبيرة ، تتفاعل بقوة مع بعضها البعض والمواد الأخرى. في الوقت نفسه ، يمكنهم تكوين روابط هيدروجينية مع O ، N ، F ، Cl ، S ، إلخ. في الماء عند درجات حرارة منخفضة ومتوسطة ، توجد كمية صغيرة (حوالي 1٪ عند درجة الحرارة وضغط الصراف الآلي) من الثنائيات ( بالنسبة لهم ~ 15 كيلو جول / مول) ، المسافة بين ~ 0.3 نانومتر. في المراحل المكثفة ، يشكل كل منها أربعة روابط هيدروجينية: اثنان كمانح واثنان كمستقبل. متوسط طول هذه الروابط في البلورية. تعديلات الجليد وحوالي 0.28 نانومتر. الزاوية О-Н ... О تميل إلى 180 درجة. يتم توجيه أربعة روابط هيدروجينية تقريبًا إلى رؤوس رباعي السطوح المنتظم (الشكل 2).
هيكل تعديلات الجليد عبارة عن شبكة ثلاثية الأبعاد. في التعديلات الكثيفة VI-VIII ، التي تكون مستقرة عند الارتفاع ، يمكن للمرء حتى التمييز بين شبكتين من هذه الشبكات "مدرجة" واحدة في الأخرى. في التعديلات الموجودة في درجات حرارة منخفضة (Ih و Ic) ، اتصالات H-O-Hمستقيمة تقريبًا وموجهة إلى رؤوس رباعي السطوح المنتظم تقريبًا. في التعديلات من الثاني إلى السادس ، تكون الروابط منحنية ، وتختلف الزوايا بينها عن رباعي السطوح ، مما يؤدي إلى زيادة الكثافة مقارنة بكثافة الجليد العادي.
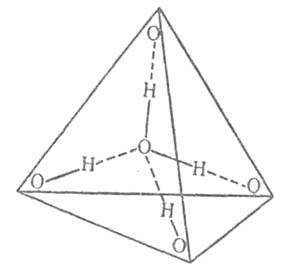
أرز. 2. مخطط التنسيق رباعي السطوح. خطوط الصلبة - ؛ الخطوط المنقطة هي روابط هيدروجينية.
لكن كثافة التعديلات II-VI أقل بكثير من تلك التي يمكن أن يحدثها الجليد. فقط في التعديلات السابع والثامن كافية كثافة عاليةالعبوات: في هيكلها ، شبكتان عاديتان مبنيتان من رباعي السطوح (على غرار تلك الموجودة في مكعبات الجليد منخفضة الحرارة مكعب ، وهو متساوي التركيب مع الماس) ، يتم إدخال إحداهما في الأخرى ؛ في الوقت نفسه ، يتم الحفاظ على نظام من الروابط الهيدروجينية المستقيمة ، ويتضاعف رقم التنسيق n ويصل إلى 8. الترتيب في الجليد السابع والثامن مشابه للترتيب في وغيرها الكثير. في الجليد العادي (Ih) والمكعب (Ic) ، وكذلك في الجليد HI ، V-VII ، لم يتم تحديد الاتجاه: كلاهما أقرب إلى شكل O معه ، والذي يمكن توجيهه إلى أي اثنين من الأشكال الرباعية السطوح المجاورة في القمم. ثابت العزل لهذه التعديلات مرتفع (أعلى من الماء السائل). التعديلات II و VIII و IX مرتبة حسب التوجيه ؛ هم ثابت العزلمنخفضة (حوالي 3). Ice VIII عبارة عن متغير مرتب حسب الترتيب الجليد السابع، والجليد التاسع - الجليد الثالث. كثافات التعديلات المطلوبة اتجاهيًا (الثامن ، التاسع) قريبة من كثافات التعديلات غير المنتظمة المقابلة (السابع ، الثالث).
توجد أيضًا شبكة ثلاثية الأبعاد من الروابط الهيدروجينية مبنية من رباعي الأسطح أيضًا في سائل في النطاق الكامل من درجة الحرارة إلى الحرجة. تفسر الزيادة في الكثافة ، كما في حالة التعديلات الكثيفة للجليد ، بانحناء الروابط الهيدروجينية وانحراف الزوايا بينها عن رباعي السطوح. يزداد ثني الروابط مع زيادة درجة الحرارة مما يؤدي إلى زيادة الكثافة. من ناحية أخرى ، عند تسخينها ، يصبح متوسط طول الروابط الهيدروجينية أطول ، مما يؤدي إلى انخفاض الكثافة. يفسر العمل المشترك لعاملين وجود أقصى كثافة للماء عند 3.98 درجة مئوية.
الخواص الكيميائية.فقط نسبة صغيرة (عند 25 درجة مئوية - حوالي 1 لكل 5 * 10 9) تخضع للتحليل الكهربائي وفقًا للمخطط: H 2 O H + + OH -. H + في البيئة المائية، بالتفاعل مع ، تشكل H 3 O + ، والتي تتحد مع 1 H 2 O لتشكيل H 5 O 2 +. المسافة O ... O في مثل هذه المجمعات أقصر بشكل ملحوظ من طول الرابطة الهيدروجينية العادية بين المحايد. ولكن نظرًا لأنه ، على ما يبدو ، ليس بالضبط في منتصف هذه الرابطة المختصرة ، ولكن أقرب إلى واحد من O ، يمكننا أن نفترض أن هناك أكسونيوم مميأ H 3 O +. تلعب هذه الظاهرة دورًا مهمًا في الكيمياء. العمليات الجارية أنظمة مختلفة، بما في ذلك البيولوجية. على وجه الخصوص ، السبب أحماض ضعيفةو / أو أسباب. H + وما يرتبط بها من OH - - خصائص مهمة محاليل مائية(انظر مؤشر الهيدروجين). تزداد درجة التحليل الكهربائي بشكل ملحوظ مع زيادة درجة الحرارة.
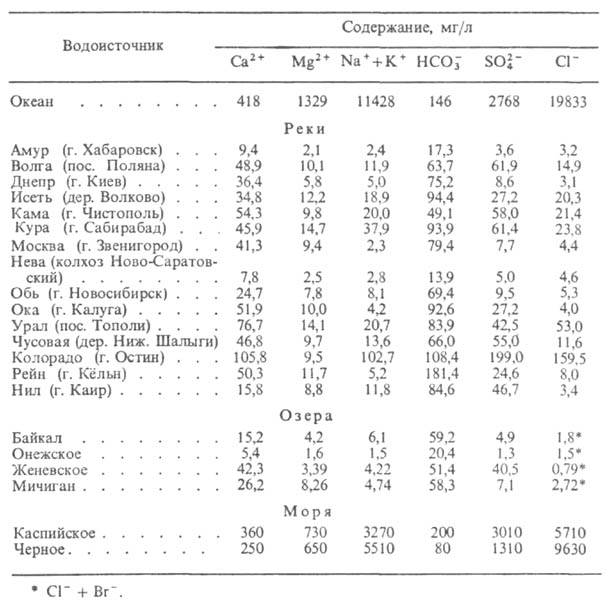
الشرب. الرقم الإجمالييجب ألا تزيد الكائنات الحية الدقيقة في 1 مل من مياه الشرب عن 100 ، عدد بكتيريا المجموعة القولونية(if-index) - لا يزيد عن 3.




