De mest berømte kemiske fænomener. Kemi omkring os Kemi og kemiske fænomener er overalt omkring os. Madlavning er også en kemisk proces. I hverdagen, uden at vide det, - præsentation
Katasonov Nikita, Savostyanova Evgenia, Zadorina Elizaveta, Dmitriev Ilya, Ermakov Pavel
Forskningsprojekt "Kemiske reaktioner i Hverdagen" forberedt af en gruppe elever i klasse 8-9 til en skolekonference forskningsarbejde . Mål og mål:
1. Identifikation af de mest brugte i hverdagen kemiske reaktioner.
2. Litteraturanalyse at fastslå essensen reaktioner.
3. Definer graden af sikkerhed (fare) af reaktionsprodukter for mennesker.
Hent:
Eksempel:
For at bruge forhåndsvisningen af præsentationer skal du oprette en Google-konto (konto) og logge ind: https://accounts.google.com
Slides billedtekster:
Kemiske reaktioner i vores dagligdag Projektdeltagere: 1. Evgenia Konstantinovna Savostyanova Grade 9 2. Elizaveta Vadimovna Zadorina Grade 8 3. Pavel Igorevich Ermakov Grade 9 4. Ilya Alekseevich Dmitriev Grade 9 5. Nikita Sergeevich Katasonov 9 Leder: 2. Kommunal budget uddannelsesinstitution"Gennemsnit helhedsskole nr. 17"
Relevansen af det valgte emne I vores tid er millioner kendt forskellige stoffer. Mange af dem bruges ikke kun i industrien og landbrug men også i hverdagen. Desværre er det ikke alle mennesker, der har elementær kemisk viden om stoffer og deres omdannelser. Vi mener, at det er nødvendigt at indgyde kemisk færdighed selv fra skolebænken. Derfor vil emnet "Kemiske reaktioner i vores dagligdag" være relevant.
Mål og formål: 1. Identifikation af de mest almindeligt anvendte kemiske reaktioner i hverdagen. 2. Litteraturanalyse for at fastslå reaktionernes karakter. 3. Bestem graden af sikkerhed (fare) af reaktionsprodukter for mennesker.
Forbrænding af naturgas Rusland er førende inden for naturgasreserver og -produktion. Derfor bruger vi i vores hjem naturgass forbrændingsreaktion til at generere varmeenergi. Naturgas - en blanding af gasser dannet i jordens tarme under anaerob nedbrydning organisk stof. Kemisk sammensætning: ethan (C2H6), propan (C3H8) butan (C4H10). Samt andre ikke-kulbrintestoffer: brint (H 2), svovlbrinte (H 2 S), kuldioxid (CO 2), nitrogen (N 2), helium (He). Hovedparten af naturgassen er metan (CH 4) - fra 92 til 98%. Det er en farveløs, let, brændbar gas, lugtfri, næsten uopløselig i vand. En blanding af metan i luft er eksplosiv. Forbrændingsreaktionen af metan CH 4 + 2O 2 = CO 2 + 2H 2 O + Q. Metan brænder med en blålig eller næsten farveløs flamme og frigiver et stort antal af varme (879 kJ/mol). Når du bruger gasudstyr i huset, er det nødvendigt at: kontrollere skorstenen, ventilere rummet, overvåge tilstanden af gasrørledninger og ikke efterlade fungerende gasudstyr uden opsyn.
Brændende tændstikker Med et stort udvalg af forskellige lightere er tændstikker meget populære. Hvad sker der, når en tændstik tændes? Her slog de den på kasserne. Der var en flamme og Stærk lugt"svovl". Processen startede under påvirkning af friktion. Først brød rødt fosfor i brand, som var på tændstikæsken 4P + 5O 2 = 2P 2 O 5 kilde til skarp lugt). Hovedet satte ild til træ C 6 H 10 O 5 + 6O 2 \u003d 6CO 2 + 5H 2 O Næsten alle forbrændingsprodukter er skadelige for kroppen. Først når en tændstik brændes, frigives en ubetydelig mængde af dem, hvilket ikke har en væsentlig effekt på en person. Men ved brug af tændstikker kemisk uddannet person skal huske, at "KAMP ER IKKE EN FARE!"
Hydrolyse af sæbe I produktion og hverdag kaldes sæbe for tekniske blandinger af vandopløselige salte af højere fedtsyrer ofte med tilsætning af nogle andre stoffer, der har vaskehandling. Blandingerne er normalt baseret på natrium (sjældent kalium og ammonium) salte af mættede og umættede fedtsyrer med antallet af kulstofatomer i molekylet fra 12 til 18 (stearinsyre, palmitinsyre, myristinsyre, laurinsyre og oliesyre). Sæber indeholder ofte også salte af naphthensyre og harpikssyrer, og nogle gange andre forbindelser, der har vaskeevne i opløsninger. Sæber er dannet af en stærk base og svag syre, derfor hydrolyseres de let: C 17 H 35 COOHa + H 2 O \u003d C 17 H 35 COOH + NaOH Hydrolysemiljøet er basisk, derfor er sæber ret aggressive mod huden, og deres hyppige brug fører til affedtning. Der er rigtig mange sorter og mærker af sæbe, og før du vælger den bedst egnede, skal du bestemme din hudtype. Fedtet hud er ofte skinnende pga stærk sved og fedtrum, det har normalt store porer. Allerede 2 timer efter vask på en serviet påført ansigtet fedtet hud efterlader pletter. Til sådan hud kræves sæbe med en let udtørrende effekt. Tør hud er tynd og meget følsom over for vind og vejr, og porerne på den er små og tynde; den revner let, fordi den ikke er fleksibel nok. Det er nødvendigt at skabe maksimal komfort og sparsom behandling for sådan hud, det er bedre at bruge dyre sæber. normal hud blød, glat, med mellemstore porer.
Hydrogenperoxid Hydrogenperoxid er den enkleste repræsentant for peroxider. Farveløs væske med en "metallisk" smag, ubegrænset opløselig i vand, alkohol og æter. Ego bruges ofte i hverdagen som blegemiddel og antiseptisk middel. Når brintoverilte nedbrydes (når vi behandler et sår), frigives vand og iltgas. 2H 2 O 2 \u003d O 2 + 2H 2 O Når ikke store doser tilsvarende frigives en lille mængde ilt. I et lille volumen er ren ilt ikke farligt, men i et stort volumen? Og med en stor mængde er ren ilt giftig og kan forårsage en pulmonal form for iltforgiftning og en skadelig effekt på det centrale nervesystem. Den første eksponering er ledsaget af følgende symptomer: irritation af lungevævet. Det kan begynde med mild irritation af halsen efterfulgt af en hoste. PÅ alvorlige tilfælde der kan være langvarig svie i brystet og en ukontrollerbar hoste. Den pulmonale form for iltforgiftning kan også forårsage et fald i lungekapacitet og et fald i evnen til at udveksle gasser, selvom disse komplikationer er yderst sjældne. Og symptomerne på den anden eksponering (toksiske CNS-skader) omfatter: synsforstyrrelser (tunnelsyn, manglende evne til at fokusere), hørenedsættelse (ringen for ørerne, udseendet af fremmede lyde), kvalme, krampetrækninger (især ansigtsmuskler), overfølsomhed til ydre stimuli og svimmelhed. Men alt dette er kun muligt, når du bruger store mængder hydrogenperoxid, og det sædvanlige 3% peroxid er ude af stand til dette.
Slukkende sodavand med eddike Processen med at slukke sodavand med eddike bruges ved æltning af dej til boller og pandekager. Bagepulver, når den er udsat høj temperatur eller et surt miljø giver en øget reaktion for at frigive kuldioxid, hvilket igen fører til pragt og porøsitet. CH 3 COOH + NaHCO 3 \u003d CH 3 COONa + H 2 O + CO 2 Spørgsmålet "at slukke eller ikke slukke sodavand med eddike ved bagning" er lige så evigt som spørgsmålet: "hvilken kom først - kyllingen eller ægget ." Men efter at have dykket ned i litteraturen og afbrudt en masse websteder, inklusive udenlandske, kom jeg til den konklusion, at dette spørgsmål højst er 70-80 år gammelt. Da jeg brød igennem rigtig mange opskrifter fra det gamle russiske køkken, fandt jeg ikke en eneste, hvor sodavand blev nævnt. Tidligere var bagværk i vores land for det meste gærbaseret, eller uden tilsætning af nogen hæve- og løsneacceleratorer overhovedet. Så, bagepulver blev opfundet af den franske kemiker Leblanc i slutningen af det 18. århundrede. Denne opfindelse kom til Rusland meget senere, efter at en ny fremstillingsmetode blev opnået. Så snart russiske husmødre havde et sådant produkt som sodavand, begyndte de at anvende og bruge det til madlavning. Hvorfor blev det besluttet at slukke sodavandet? Ja, simpelthen fordi vores tradition med at spise alt "hot, hot" i dette tilfælde kun er skadeligt. hurtig sodavand ind varm bagning har en meget ubehagelig "sæbeagtig" smag. Det, der blev "rettet" ved at slukke det, nemlig at tilsætte kogende vand eller fermenterede mælkeprodukter til sodavand. Til pandekager denne metode og giver nu meget gode resultater. Men kan du forestille dig, hvad der vil ske med sandkagedejen, hvis du hælder et glas kogende vand i den? Svaret er indlysende. Derfor blev det opfundet for at erstatte kogende vand el mejeriprodukter fortyndet med 9% eddike eller citronsaft.
Konklusion Vi kan observere mange kemiske reaktioner ikke kun i kemitimerne, men også i hverdagen. Disse reaktioner er ikke kun sikre (underlagt sikkerhedsregler), men nogle af dem er ubrugelige. For eksempel: at slukke sodavand med eddike, enhver dygtig kok vil sige, at det er spild af tid. Men uden sådanne reaktioner som hydrolyse og forbrænding, har vi simpelthen ingen idé om yderligere eksistens. Under disse kemiske reaktioner frigives gasser. De er sikre (i en vis mængde). Ved brug af kemiske stoffer i hverdagen er det nødvendigt at overholde sikkerhedsforskrifter.
Informationskilder 1. Kritzman, V.A., Stanzo, V.V. encyklopædisk ordbog ung kemiker [Tekst] - M.: Pædagogik, 1990. 2. Lavrova, S.A. Underholdende kemi [Tekst] -M. : White City, 2009. 3. Ryumin, V. Entertaining Chemistry [Tekst] - M .: Tsentrpoligraf, 2012. 4. Kurdyumov, G.M. 1234 spørgsmål om kemi [Tekst] - M.: Mir, Binom, 2007. 5. Guzey, L.S., Kuznetsov, V.N. Ny mappe i kemi [Tekst] -M. : Ursa Major, 1999 6. Wikipedia [Elektronisk ressource] - Adgangstilstand: ru.wikipedia.org 7. Egorova, A.S. Kemivejleder [Tekst]-M. : Phoenix, 2007 8. Kemi og liv [Elektronisk ressource] - Adgangstilstand: http://www.hij.ru 9 . Kemi omkring os [Elektronisk ressource] - Adgangstilstand: http://interestingchem.narod.ru/chemaround.htm
Disse omfatter dem, der kan observeres i hverdagen moderne mand. Nogle af dem er ganske enkle og indlysende, alle kan observere dem i deres køkken, som et eksempel med at brygge te.
Ved at bruge eksemplet med stærk (koncentreret) tebrygning kan du selvstændigt udføre et andet eksperiment: lysne te med en skive citron. På grund af syrerne i citronsaft, vil væsken igen ændre sin sammensætning.
Hvilke andre fænomener kan du observere i hverdagen? For eksempel omfatter kemiske fænomener processen med brændstofforbrænding i en motor.
For at forenkle kan reaktionen af brændstofforbrænding i motoren beskrives som følger: oxygen + brændstof = vand + carbondioxid.
Generelt i motorrummet intern forbrænding der er flere reaktioner, der involverer brændstof (kulbrinter), luft og en tændingsgnist. Eller rettere, ikke bare brændstof - en brændstof-luft-blanding af kulbrinter, ilt, nitrogen. Før antændelse komprimeres blandingen og opvarmes.
Forbrændingen af blandingen sker på en brøkdel af et sekund, som et resultat ødelægges bindingen mellem brint- og carbonatomerne. På grund af dette frigives en stor mængde energi, som sætter stemplet i bevægelse, og det - krumtapakslen.
Efterfølgende kombineres brint- og kulstofatomer med oxygenatomer, vand og kuldioxid dannes.
Ideelt set skulle den fuldstændige forbrændingsreaktion se sådan ud: CnH2n+2 + (1,5n+0,5)O2 = nCO2 + (n+1)H2O. I virkeligheden er forbrændingsmotorer ikke så effektive. Antag, at hvis ilt ikke er nok under reaktionen, dannes CO som følge af reaktionen. Og ved større mangel på ilt dannes der sod (C).
Dannelsen af plak på metaller som følge af oxidation (rust på jern, patina på kobber, mørkfarvning af sølv) er også fra kategorien af husholdningskemiske fænomener.
Lad os tage jern som et eksempel. Rustning (oxidation) opstår under påvirkning af fugt (luftfugtighed, direkte kontakt med vand). Resultatet af denne proces er jernhydroxid Fe2O3 (mere præcist Fe2O3 * H2O). Du kan se den som løs, ru, orange eller rød- brun plakette på overfladen af metalprodukter.
Et andet eksempel kunne være grøn plakette(patina) på overfladen af kobber- og bronzeprodukter. Det dannes over tid under påvirkning af atmosfærisk ilt og luftfugtighed: 2Cu + O2 + H2O + CO2 = Cu2CO5H2 (eller CuCO3 * Cu(OH)2). Det resulterende basiske kobbercarbonat findes også i naturen i form af mineralet malakit.
Og et andet eksempel på en langsom oxidativ reaktion af et metal under husholdningsforhold er dannelsen af en mørk belægning af sølvsulfid Ag2S på overfladen af sølvgenstande: smykker, bestik osv.
"Ansvaret" for dets forekomst bæres af svovlpartikler, som er til stede i form af svovlbrinte i den luft, vi indånder. Sølv kan også blive mørkere ved kontakt med svovlholdigt madvarer(æg, for eksempel). Reaktionen ser således ud: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
Lad os gå tilbage til køkkenet. Her kan du overveje et par mere mærkværdige kemiske fænomener: dannelsen af kalk i kedlen er et af dem.
Under hjemlige forhold er der ingen kemikalier rent vand, den er altid inde forskellig koncentration opløste metalsalte og andre stoffer. Hvis vandet er mættet med calcium- og magnesiumsalte (hydrocarbonater), kaldes det hårdt. Jo højere saltkoncentrationen er, jo hårdere er vandet.
Når sådant vand opvarmes, nedbrydes disse salte til kuldioxid og et uopløseligt bundfald (CaCO3 og MgCO3). Du kan observere disse faste aflejringer ved at kigge ind i elkedlen (og også ved at se på varmeelementerne i vaskemaskiner, opvaskemaskiner og strygejern).
Udover calcium og magnesium (hvoraf der dannes karbonatskaller) er jern også ofte til stede i vand. Under de kemiske reaktioner af hydrolyse og oxidation dannes der hydroxider fra det.
Når du i øvrigt er ved at slippe af med kalk i elkedlen, kan du iagttage endnu et eksempel på underholdende kemi i hverdagen: alm. bordeddike og citronsyre. En kedel med en opløsning af eddike/citronsyre og vand koges, hvorefter belægningen forsvinder.
Og uden et andet kemisk fænomen ville der ikke være lækre mors tærter og boller: vi taler om at slukke sodavand med eddike.
Når mor slukker sodavand i en ske med eddike, sker der følgende reaktion: NaHCO3 + CH3COOH = CH3COONa + H2O + CO2. Den resulterende kuldioxid har en tendens til at forlade dejen - og ændrer derved dens struktur, gør den porøs og løs.
Du kan i øvrigt sige til din mor, at det slet ikke er nødvendigt at slukke sodavanden – hun reagerer alligevel, når dejen kommer i ovnen. Reaktionen vil dog gå lidt værre, end når sodavand er slukket. Men ved en temperatur på 60 grader (og helst 200) nedbrydes sodavand til natriumkarbonat, vand og samme kuldioxid. Sandt nok kan smagen af færdiglavede tærter og boller være værre.
Listen over husholdningskemiske fænomener er ikke mindre imponerende end listen over sådanne fænomener i naturen. Takket være dem har vi veje (asfaltfremstilling er et kemisk fænomen), huse (murstensbrænding), smukke stoffer til tøj (farvning). Hvis man tænker over det, bliver det tydeligt, hvor mangefacetteret og interessant kemividenskaben er. Og hvor meget fordel kan man få ved at forstå dens love.
Del I
1. Ændringer der sker med kroppe og stoffer er
2. Folks holdning til kemi.
3. Alkymiens artefakt er de vises sten.
Han (specificer rolle):
1) blanding af eliksirer
2) healing, healing
4. Udfyld tabellen "Store russiske kemikere".

Del II
1. Vælg synonymer til begrebet " kemiske fænomener».
2) kemiske reaktioner
3) fænomener, hvor andre stoffer dannes af nogle stoffer
4) fænomener, hvor farven på et stof ændres, et bundfald eller gas dannes
2. Opdel fænomener i fysisk (A) og kemisk (B).
3. Analyser tegningerne og navngiv processen.

a) forbrænding er et kemisk fænomen
b) at servere bolden er et fysisk fænomen
c) opløsning er et fysisk fænomen
d) sodavandslukning - et kemisk fænomen
e) forbrænding er et kemisk fænomen
f) tiltrækning af en magnet er et fysisk fænomen
Etabler en overensstemmelse mellem et fysisk eller kemisk fænomen og processen afbildet i figuren.
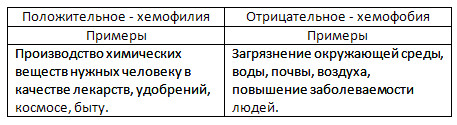
4. Lav en præsentation om et af de foreslåede emner: "Den negative betydning af kemi" eller " Positiv værdi Kemi", ved hjælp af internettet.
5. Kryds "ekstra" ud:
frysning af vand, fordampning af vand, kogning af vand, nedbrydning af vand til brint og ilt, vandfiltrering.
6. Udfyld tabellen "Fysiske og kemiske fænomener" ved hjælp af resultaterne af dine observationer af processer i hverdagen og i naturen.

7. Brug internettet og andre informationskilder (videnskabelig litteratur) og lav en besked om en af de tre store russiske kemikeres liv og arbejde i henhold til følgende plan:
1) barndom;
2) studere i ungdommen;
3) videnskabelig aktivitet, vigtigste videnskabelige resultater.
D. I. Mendeleev - blev født i familien til direktøren for skolens administrator, var 14 og det mest elskede barn i familien. Han blev opdraget af sin mor, da hans far kort efter hans fødsel blev blind og døde. Mendeleev i gymnastiksalen var ikke kendetegnet ved særlig flid, han kunne især ikke lide Guds lov. Han ville ind medicinsk akademi, men biologien var uden for hans magt, og gik ind i pædagogikken.
Han studerede godt, men blev meget syg, og lægerne rådede ham til at tage sydpå. Han kom sig, forsvarede sig glimrende og begyndte forskningsarbejde.
1. Undersøgt fænomenet isomorfisme.
2. Designet et pyknometer - en enhed til bestemmelse af densiteten af væsker.
3. Åbnede væskers kogepunkt, deres kritiske temperatur.
4. Udgav den første lærebog d organisk kemi i Rusland.
5. Lavede hydratteorien for opløsninger.
6. Opdagede det periodiske system kemiske elementer, formulerede den periodiske lov.
7. Ud fra loven og tabellen forudsagde han eksistensen af flere kemiske grundstoffer.
Send dit gode arbejde i videnbasen er enkel. Brug formularen nedenfor
Studerende, kandidatstuderende, unge forskere, der bruger videnbasen i deres studier og arbejde, vil være dig meget taknemmelig.
opslået på http://www.allbest.ru/
Zaporozhye gymnasiet på І-ІІІ niveauer № 90
Kemiske fænomener i hverdagen og hverdagen
7. klasses elev
Dmitry Baluev
Introduktion
kemisk reaktion brændstofoxidation
Verden omkring os, med al dens rigdom og mangfoldighed, lever i henhold til love, der er ret lette at forklare ved hjælp af sådanne videnskaber som fysik og kemi. Og selv livet for en så kompleks organisme som en person er baseret på intet andet end kemiske fænomener og processer.
Du har helt sikkert bemærket mere end én gang noget som hvordan mor har det sølv ring mørkere med tiden. Eller hvordan et søm ruster. Eller hvordan træstammer brænder til aske. Men selvom din mor ikke kan lide sølv, og du aldrig har været på vandretur, har du set præcis, hvordan en tepose bliver brygget i en kop.
Hvad har alle disse eksempler til fælles? Og det faktum, at de alle er kemiske fænomener.
Så de mest almindelige eksempler på kemiske fænomener i livet og hverdagen:
søm ruster
brændstof forbrænding
nedbør
gæring af druesaft
papir rådner
parfumesyntese
mørkere sølvørering
udseendet af grøn plak på bronze
kedelstensdannelse i kedler
slukningssodavand med eddike
råddent kød
brændende papir
Vil du have detaljer? Et elementært eksempel er en kedel sat i brand. Efter et stykke tid vil vandet begynde at varme op og derefter koge. Vi vil høre et karakteristisk sus, dampstråler vil flyve ud af kedlens hals. Hvor kom det fra, for det var ikke oprindeligt i opvasken! Ja, men vand bestemt temperatur, begynder at blive til gas, ændrer sin fysisk tilstand fra flydende til gasformig. De der. det forblev det samme vand, først nu i form af damp. Dette er et fysisk fænomen.
Og vi vil se kemiske fænomener, hvis vi putter en pose teblade i kogende vand. Vand i et glas eller en anden beholder bliver rødbrunt. En kemisk reaktion vil opstå: under påvirkning af varme vil tebladene begynde at dampe og frigive farvepigmenter og smagsegenskaber iboende i denne plante. Vi får et nyt stof - en drink med specifikke, unikke kvalitetsegenskaber. Hvis vi tilføjer et par spiseskefulde sukker der, vil det opløses (fysisk reaktion), og teen bliver sød (kemisk reaktion). Således er fysiske og kemiske fænomener ofte relaterede og indbyrdes afhængige. For eksempel hvis den samme tepose er placeret i koldt vand, vil reaktionen ikke forekomme, tebladene og vandet vil ikke interagere, og sukkeret vil heller ikke opløses.
Kemiske fænomener er således dem, hvor nogle stoffer bliver til andre (vand til te, vand til sirup, brænde til aske osv.) Ellers kaldes et kemisk fænomen en kemisk reaktion.
Vi kan bedømme, om kemiske fænomener opstår ved bestemte tegn og ændringer, der observeres i et bestemt legeme eller stof. Så de fleste kemiske reaktioner er ledsaget af følgende "identifikationsmærker":
som et resultat eller i løbet af et sådant bundfald udfældes;
der er en ændring i stoffets farve;
gas kan frigives, for eksempel kulilte under forbrænding;
der er en absorption eller omvendt frigivelse af varme;
lysudsendelse er mulig.
For at kemiske fænomener kan observeres, dvs. reaktioner opstår, visse betingelser er nødvendige:
de reagerende stoffer skal være i kontakt, være i kontakt med hinanden (dvs. de samme teblade skal hældes i et krus kogende vand);
det er bedre at male stofferne, så vil reaktionen forløbe hurtigere, interaktionen vil ske hurtigere (sukker-sand er mere tilbøjelige til at opløses, smelte til varmt vand end klumpet);
så mange reaktioner kan opstå, skal du ændre temperatur regime reagerende komponenter ved at afkøle eller opvarme dem til en bestemt temperatur.
Du kan observere det kemiske fænomen empirisk. Men for at beskrive det på papir, kan du bruge kemisk ligning(kemiske reaktionsligninger).
Nogle af disse forhold virker også for forekomsten af fysiske fænomener, for eksempel en ændring i temperatur eller direkte kontakt mellem genstande, kroppe med hinanden. For eksempel, hvis du slår hovedet af et søm hårdt nok med en hammer, kan det deformeres, miste sin sædvanlige form. Men hun vil forblive et sømhoved. Eller, når du tænder for den elektriske lampe i netværket, vil wolframglødetråden inde i den begynde at varme op og lyse. Stoffet, som tråden er lavet af, vil dog forblive den samme wolfram.
Men lad os se på nogle flere eksempler. Vi forstår jo alle, at kemi ikke kun forekommer i reagensglas i skolens laboratorium.
1. Kemiske fænomener i hverdagen
Disse omfatter dem, der kan observeres i det moderne menneskes daglige liv. Nogle af dem er ganske enkle og indlysende, alle kan observere dem i deres køkken, som et eksempel med at brygge te.
Ved at bruge eksemplet med stærk (koncentreret) tebrygning kan du selvstændigt udføre et andet eksperiment: lysne te med en skive citron. På grund af de syrer, der er indeholdt i citronsaft, vil væsken igen ændre sin sammensætning.
Hvilke andre fænomener kan du observere i hverdagen? For eksempel omfatter kemiske fænomener processen med brændstofforbrænding i en motor.
For at forenkle kan reaktionen af brændstofforbrænding i motoren beskrives som følger: ilt + brændstof = vand + kuldioxid.
Generelt finder flere reaktioner sted i kammeret i en forbrændingsmotor, hvori brændstof (kulbrinter), luft og en tændingsgnist er involveret. Eller rettere, ikke bare brændstof - en brændstof-luft-blanding af kulbrinter, ilt, nitrogen. Før antændelse komprimeres blandingen og opvarmes.
Forbrændingen af blandingen sker på en brøkdel af et sekund, som et resultat ødelægges bindingen mellem brint- og carbonatomerne. På grund af dette frigives en stor mængde energi, som sætter stemplet i bevægelse, og det - krumtapakslen.
Efterfølgende kombineres brint- og kulstofatomer med oxygenatomer, vand og kuldioxid dannes.
Ideelt set skulle den fuldstændige forbrændingsreaktion se sådan ud: CnH2n+2 + (1,5n+0,5)O2 = nCO2 + (n+1)H2O. I virkeligheden er forbrændingsmotorer ikke så effektive. Antag, at hvis ilt ikke er nok under reaktionen, dannes CO som følge af reaktionen. Og ved større mangel på ilt dannes der sod (C).
Dannelsen af plak på metaller som følge af oxidation (rust på jern, patina på kobber, mørkfarvning af sølv) er også fra kategorien af husholdningskemiske fænomener.
Lad os tage jern som et eksempel. Rustning (oxidation) opstår under påvirkning af fugt (luftfugtighed, direkte kontakt med vand). Resultatet af denne proces er jernhydroxid Fe2O3 (mere præcist Fe2O3 * H2O). Du kan se det som en løs, ru, orange eller rødbrun belægning på overfladen af metalprodukter.
Et andet eksempel er den grønne belægning (patina) på overfladen af kobber- og bronzegenstande. Det dannes over tid under påvirkning af atmosfærisk ilt og luftfugtighed: 2Cu + O2 + H2O + CO2 = Cu2CO5H2 (eller CuCO3 * Cu(OH)2). Det resulterende basiske kobbercarbonat findes også i naturen i form af mineralet malakit.
Og et andet eksempel på en langsom oxidativ reaktion af et metal under husholdningsforhold er dannelsen af en mørk belægning af sølvsulfid Ag2S på overfladen af sølvgenstande: smykker, bestik osv.
"Ansvaret" for dets forekomst bæres af svovlpartikler, som er til stede i form af svovlbrinte i den luft, vi indånder. Sølv kan også blive mørkere ved kontakt med svovlholdige fødevarer (f.eks. æg). Reaktionen ser således ud: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
Lad os gå tilbage til køkkenet. Her kan du overveje et par mere mærkværdige kemiske fænomener: dannelsen af kalk i kedlen er et af dem.
Under husholdningsforhold er der ikke noget kemisk rent vand; metalsalte og andre stoffer er altid opløst i det i forskellige koncentrationer. Hvis vandet er mættet med calcium- og magnesiumsalte (hydrocarbonater), kaldes det hårdt. Jo højere saltkoncentrationen er, jo hårdere er vandet.
Når sådant vand opvarmes, nedbrydes disse salte til kuldioxid og et uopløseligt bundfald (CaCO3 og MgCO3). Du kan observere disse faste aflejringer ved at kigge ind i elkedlen (og også ved at se på varmeelementerne i vaskemaskiner, opvaskemaskiner og strygejern).
Udover calcium og magnesium (hvoraf der dannes karbonatskaller) er jern også ofte til stede i vand. Under de kemiske reaktioner af hydrolyse og oxidation dannes der hydroxider fra det.
Når du i øvrigt er ved at slippe af med kalk i kedlen, kan du iagttage endnu et eksempel på underholdende kemi i hverdagen: almindelig bordeddike og citronsyre klarer sig godt med aflejringer. En kedel med en opløsning af eddike/citronsyre og vand koges, hvorefter belægningen forsvinder.
Og uden et andet kemisk fænomen ville der ikke være lækre mors tærter og boller: vi taler om at slukke sodavand med eddike.
Når mor slukker sodavand i en ske med eddike, sker der følgende reaktion: NaHCO3 + CH3COOH = CH3COONa + H2O + CO2. Den resulterende kuldioxid har en tendens til at forlade dejen - og ændrer derved dens struktur, gør den porøs og løs.
Du kan i øvrigt sige til din mor, at det slet ikke er nødvendigt at slukke sodavanden – hun reagerer alligevel, når dejen kommer i ovnen. Reaktionen vil dog gå lidt værre, end når sodavand er slukket. Men ved en temperatur på 60 grader (og helst 200) nedbrydes sodavand til natriumkarbonat, vand og samme kuldioxid. Sandt nok kan smagen af færdiglavede tærter og boller være værre.
Listen over husholdningskemiske fænomener er ikke mindre imponerende end listen over sådanne fænomener i naturen. Takket være dem har vi veje (asfaltfremstilling er et kemisk fænomen), huse (murstensbrænding), smukke stoffer til tøj (farvning). Hvis man tænker over det, bliver det tydeligt, hvor mangefacetteret og interessant kemividenskaben er. Og hvor meget fordel kan man få ved at forstå dens love.
2. Interessante kemiske fænomener
Jeg vil gerne tilføje nogle interessante ting. Blandt de mange, mange fænomener, som naturen og mennesket har opfundet, er der særlige, som er svære at beskrive og forklare. De omfatter afbrænding af vand. Hvordan kan det være, spørger du, fordi vand ikke brænder, det slukker ild? Hvordan kan hun brænde? Og her er sagen.
Forbrænding af vand er et kemisk fænomen, hvor ilt-hydrogen-bindinger brydes i vand med en blanding af salte under påvirkning af radiobølger. Resultatet er ilt og brint. Og det er selvfølgelig ikke vandet i sig selv, der brænder, men brint.
Samtidig når den en meget høj forbrændingstemperatur (mere end halvanden tusinde grader), plus at der igen dannes vand under reaktionen.
Dette fænomen har længe været interessant for forskere, der drømmer om at lære at bruge vand som brændstof. For eksempel til biler. Indtil videre er dette noget fra fantasiens område, men hvem ved, hvad videnskabsmænd vil være i stand til at opfinde meget snart. En af de største problemer er, at når vandet brænder, frigives der mere energi, end der bruges på reaktionen.
I øvrigt kan noget lignende observeres i naturen. Ifølge en teori er store enkeltbølger, der ser ud som om fra ingenting, faktisk resultatet af en brinteksplosion. Elektrolysen af vand, som fører til det, udføres på grund af indtrængen af elektriske udladninger (lyn) på overfladen af saltvandet i havene og oceanerne.
Men ikke kun i vand, men også på land, kan man observere fantastiske kemiske fænomener. Hvis du havde en chance for at besøge en naturlig hule, ville du helt sikkert kunne se der bizarre, smukke naturlige "istapper" hænge fra loftet - drypsten. Hvordan og hvorfor de optræder, forklares af et andet interessant kemisk fænomen.
En kemiker, der ser på en drypsten, ser selvfølgelig ikke en istap, men calciumcarbonat CaCO3. Grundlaget for dets dannelse er spildevand, naturlig kalksten, og selve drypsten er bygget på grund af udfældningen af calciumcarbonat (nedadgående vækst) og atomernes adhæsionskraft i krystalgitter(vækst i bredden).
Forresten kan lignende formationer stige fra gulvet til loftet - de kaldes stalagmitter. Og hvis drypsten og stalagmitter mødes og smelter sammen til solide søjler, kaldes de stalagnater.
Konklusion
Mange fantastiske, smukke såvel som farlige og skræmmende kemiske fænomener opstår i verden hver dag. Fra mange har folk lært at drage nytte: de skaber byggematerialer, laver mad, får køretøjer til at rejse lange afstande og meget mere.
Uden mange kemiske fænomener havde eksistensen af liv på jorden ikke været mulig: Uden ozonlaget ville mennesker, dyr, planter ikke have overlevet pga. ultraviolette stråler. Uden plantefotosyntese ville dyr og mennesker ikke have noget at trække vejret, og uden respirationens kemiske reaktioner ville dette spørgsmål slet ikke være relevant.
Fermentering gør det muligt at lave mad, og det lignende kemiske fænomen forrådnelse nedbryder proteiner til enklere forbindelser og returnerer dem til kredsløbet af stoffer i naturen.
Dannelsen af oxid, når kobber opvarmes, ledsaget af en lys glød, forbrænding af magnesium, smeltning af sukker osv., betragtes også som kemiske fænomener. Og find dem en nyttig brug.
Hostet på Allbest.ru
...Lignende dokumenter
Problemet med tab af menneskeliv i brande er et spørgsmål af særlig bekymring. Definition af brandsikkerhed, systemets hovedfunktioner til dets levering. Årsager og kilder til brande på arbejdspladsen. Brandsikkerhed i hjemmet. Brandforebyggende foranstaltninger.
abstract, tilføjet 16/02/2009
Årsager til brande i hjemmet og grundlæggende brandsikkerhedsregler. Regler for håndtering af gas- og gasapparater. Rygning i sengen er en af hovedårsagerne til brande i lejligheder. Brandslukningsforanstaltninger, evakuering af personer og ejendom inden brandvæsenets ankomst.
abstract, tilføjet 24/01/2011
Essensen af barnets mentale, fysiske og sociale tryghed. Regler for sikker adfærd for børn i hjemmet, Trafik fodgænger og passager køretøj. Metoder til at danne en forsigtig holdning til potentielt farlige situationer.
semesteropgave, tilføjet 24.10.2014
Begrebet socialt farlige fænomener og årsagerne til deres forekomst. Fattigdom er resultatet af et fald i levestandarden. Sult som følge af mangel på mad. Kriminalisering af samfundet og social katastrofe. Metoder til beskyttelse mod socialt farlige fænomener.
kontrolarbejde, tilføjet 02/05/2013
Overvejelse af funktionerne i udviklingen af brande, startende fra scenen med ulmende forbrænding. De vigtigste tegn på en brand fra en lav-effekt antændelseskilde. Undersøgelsen af versionen af forekomsten af en brand som følge af spontane forbrændingsprocesser.
præsentation, tilføjet 26/09/2014
Elektrisk skade på arbejde og hjemme. Effekten af elektrisk strøm på den menneskelige krop. Elektrisk skade. Nederlagsbetingelser elektrisk stød. Tekniske metoder og midler til elektrisk sikkerhed. Optimering af beskyttelse i distributionsnet.
abstrakt, tilføjet 01/04/2009
Årsager og mulige konsekvenser brande. De vigtigste skadelige faktorer: brænding, antændelse, antændelse. Brandslukningsmetoder. Klassificering af midler og karakteristika for slukningsmidler. Grundlæggende brandsikkerhedsforanstaltninger i hverdagen og førstehjælp.
abstract, tilføjet 04/04/2009
Definition af begrebet og typer af farlige hydrologiske fænomener. Bekendtskab med historien om de mest forfærdelige oversvømmelser. Beskrivelse af den destruktive handling af en tsunami. Årsager og konsekvenser af den limnologiske katastrofe. Mekanisme for dannelse og kraft af mudderstrømme.
præsentation, tilføjet 22.10.2015
Årsager, grader og hovedtegn på kemiske forbrændinger. Funktioner af kemiske forbrændinger af øjne, spiserør og mave. Regler for arbejde med syrer og baser. Førstehjælp ved modtagelse kemisk forbrænding. Foranstaltninger til forebyggelse af kemiske forbrændinger.
test, tilføjet 14/05/2015
Typer af hjemlige hændelser med fatalårsagerne til deres forekomst. Forgiftning af rengøringsmidler og rengøringsmidler, førstehjælp. Advarsel madforgiftning. Gasudslip i lejligheden. Ætsende stoffer, kogende væsker. Foranstaltninger til forebyggelse af forbrændinger.




