الخصائص الفيزيائية والكيميائية لحمض الخليك. تطبيقات حامض الخليك
يعمل مبنى كولبي حمض الاسيتيك، وفي الوقت نفسه ، تم أخيرًا توضيح جميع الأحماض العضوية الأخرى وتم تقليص دور الكيميائيين اللاحقين فقط إلى الانقسام - بسبب الاعتبارات النظرية وسلطة جيرارد ، صيغ كولبي إلى النصف وترجمتها إلى لغة وجهات النظر البنيوية ، بسبب تحول الصيغة C2H6.C2O4H2 إلى CH3.CO (OH).
2. خصائص حامض الخليك
الأحماض الكربوكسيلية - المركبات العضوية التي تحتوي على مجموعة أو أكثر من مجموعات الكربوكسيل -COOH ، المرتبطة بجذر الهيدروكربون.
تعود الخواص الحمضية للأحماض الكربوكسيلية إلى تحول كثافة الإلكترون إلى الأكسجين الكربوني وما ينتج عنه من استقطاب إضافي (مقارنة بالكحوليات) للرابطة О - Н. في محلول مائيتتفكك الأحماض الكربوكسيلية إلى أيونات:مع زيادة الوزن الجزيئي ، تقل قابلية ذوبان الأحماض في الماء. وفقًا لعدد مجموعات الكربوكسيل ، يتم تقسيم الأحماض إلى أحادي (أحادي الكربوكسيل) ومتعدد القاعدة (ثنائي الكربوكسيل ، ثلاثي الكربوكسيل ، إلخ).
وفقًا لطبيعة الجذور الهيدروكربونية ، تتميز الأحماض المشبعة وغير المشبعة والعطرية.
يتم إعطاء الأسماء المنهجية للأحماض من خلال اسم الهيدروكربون المقابل مع إضافة اللاحقة -وفاياوالكلمات حامض. غالبًا ما يتم استخدام الأسماء التافهة أيضًا.
بعض الأحماض المشبعة أحادية القاعدة
|
معادلة |
اسم |
|
|
منهجي |
تافه |
|
|
الميثان |
شكلية |
|
|
الإيثان |
اسيتيك |
|
|
البروبان |
بروبيوني |
|
|
البيوتان |
زيتي |
|
|
البنتان |
حشيشة الهر |
|
|
الهكسان |
كابرون |
|
|
خماسي الطور |
النخلة |
|
|
سباعي |
دهني |
|
الأحماض الكربوكسيلية شديدة التفاعل. يتفاعلون مع مواد مختلفةوتشكيل مجموعة متنوعة من المركبات ، من بينها أهمية عظيمةلديك المشتقات الوظيفية، بمعنى آخر. المركبات التي تم الحصول عليها نتيجة التفاعلات في مجموعة الكربوكسيل.
2.1 تكوين الأملاح أ) عند التفاعل مع المعادن:
2RCOOH + Mg® (RCOO) 2Mg + H2
ب) في التفاعلات مع هيدروكسيدات المعادن:
2 روكوه + هيدروكسيد الصوديوم + ركونا + H2O
بدلاً من الأحماض الكربوكسيلية ، غالبًا ما تستخدم هاليداتها الحمضية: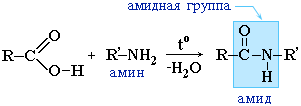 |
أميدات اللعب دورا هامافي الطبيعة. جزيئات الببتيدات الطبيعية والبروتينات مبنية من الأحماض الأمينية بمشاركة مجموعات الأميد - روابط الببتيد.
الخليك (حمض إيثانويك).
الصيغة: CH 3 - COOH ؛ سائل عديم اللون واضح مع رائحة نفاذة؛ تحت نقطة الانصهار (درجة الانصهار 16.6 درجة مئوية) كتلة شبيهة بالجليد (لذلك ، يسمى حمض الأسيتيك المركز أيضًا حمض الخليك الجليدي). قابل للذوبان في الماء والإيثانول.
الجدول 1. الخصائص الفيزيائية لحمض الخليك
| اسم | الصيغة الحمضية |
الذوبان (جم / 100 مل ماء ؛ 25 درجة مئوية) | كا (عند 25 درجة مئوية) |
|||||
|
أملاحه (استرات) |
||||||||
|
اسيتيك |
الإيثان | |||||||
عمل الدورة
حول الموضوع:
"حمض الاسيتيك"
عمل من قبل: _____________
______________________
التحقق:_____________
______________________
فولجوجراد 2004
مقدمة …………………………………………………………… .3
1. اكتشاف حامض الخليك ………………… ..5
2. خواص حامض الخليك …………………… .. 13
3. الحصول على حامض الخليك ……………………. 19
4. استخدام حامض الخليك ………………… .22
الخلاصة ……………………………………………… ... 26
قائمة الأدب المستعمل ……………… ..… 27
مقدمة
حمض الأسيتيك ، CH3COOH ، سائل عديم اللون قابل للاشتعال برائحة نفاذة ، قابل للذوبان في الماء بدرجة عالية. له طعم حامض مميز كهرباء.
كان حمض الخليك هو الوحيد الذي عرفه الإغريق القدماء. ومن هنا اسمها: "أوكسوس" - طعم حامض حامض. حمض الخليك ابسط شكلالأحماض العضوية ، وهي جزء لا يتجزأ من الدهون النباتية والحيوانية. بتركيزات صغيرة ، توجد في الأطعمة والمشروبات وتشارك في عمليات التمثيل الغذائي أثناء نضج الثمار. غالبًا ما يوجد حمض الخليك في النباتات ، في إفرازات الحيوانات. تسمى أملاح وإسترات حمض الأسيتيك الأسيتات.
حمض الخليك ضعيف (ينفصل جزئيًا فقط في محلول مائي). ومع ذلك ، نظرًا لأن البيئة الحمضية تمنع النشاط الحيوي للكائنات الحية الدقيقة ، يتم استخدام حمض الأسيتيك في التعليب منتجات الطعامكما هو الحال في المخللات.
يتم الحصول على حمض الخليك عن طريق أكسدة الأسيتالديهيد وطرق أخرى ، ويتم الحصول على حمض الأسيتيك الغذائي عن طريق تخمير حمض الأسيتيك للإيثانول. تستخدم للحصول على المواد الطبية والعطرية ، كمذيب (على سبيل المثال ، في إنتاج أسيتات السليلوز) ، في شكل خل المائدةفي صناعة التوابل والمخللات والأغذية المعلبة. يشارك حمض الخليك في العديد من عمليات التمثيل الغذائي في الكائنات الحية. وهو أحد الأحماض المتطايرة الموجودة في جميع الأطعمة تقريبًا ، وهو حامض في الطعم والمكون الرئيسي في الخل.
الغرض من هذا العمل: دراسة خصائص وإنتاج واستخدام حمض الأسيتيك.
أهداف هذه الدراسة:
1. أخبر عن تاريخ اكتشاف حمض الأسيتيك
2. دراسة خصائص حامض الخليك
3. وصف طرق إنتاج حمض الأسيتيك
4. كشف ملامح استخدام حامض الخليك
1. اكتشاف حمض الخليك
كانت بنية حمض الأسيتيك محل اهتمام الكيميائيين منذ اكتشاف Dumas لحمض الخليك ثلاثي الكلور ، حيث وجه هذا الاكتشاف ضربة لنظرية بيرزيليوس الكهروكيميائية السائدة آنذاك. هذا الأخير ، الذي يوزع العناصر إلى كهربي إيجابي وكهربائي ، لم يعترف بإمكانية الاستبدال في المواد العضويةآه ، بدون تغيير عميق في خواصهم الكيميائية ، الهيدروجين (عنصر حساس للكهرباء) بواسطة الكلور (عنصر كهرسلبي) ، ولكن في غضون ذلك ، وفقًا لملاحظات دوما ("Comptes rendus" لأكاديمية باريس ، 1839) ، أن "إدخال الكلور بدلاً من الهيدروجين لا يغير تمامًا الخصائص الخارجية للجزيئات ..." ، ولهذا يطرح دوما السؤال "هل الآراء الكهروكيميائية والأفكار حول القطبية المنسوبة إلى الجزيئات (الذرات) تستريح؟ أجسام بسيطة، على الحقائق الواضحة بحيث يمكن اعتبارها أشياء للإيمان غير المشروط ؛ إذا كانت تعتبر فروضًا ، فهل تتناسب هذه الفرضيات مع الحقائق؟ ... يجب الاعتراف ، كما يقول ، أن الأمر ليس كذلك. في ليس الكيمياء العضوية خيطنا التوجيهي هو التشابه ، وهي نظرية تقوم على الحقائق ، كما هو معروف ، لا تتفق إلا قليلاً مع النظريات الكهروكيميائية. في الكيمياء العضوية ، تلعب نظرية الاستبدال نفس الدور ... وربما سيظهر المستقبل أن كلا الرأيين أكثر ارتباطًا ، وأنهما يتبعان نفس الأسباب ويمكن تعميمهما تحت نفس الاسم. في غضون ذلك ، على أساس تحويل حمض يو إلى حمض كلورو أسيتيك وألدهيد إلى كلورالديهيد (كلورال) ومن حقيقة أنه في هذه الحالات يمكن استبدال كل الهيدروجين بكمية متساوية من الكلور دون تغيير الطبيعة الكيميائية الأساسية لل المادة ، يمكننا أن نستنتج أنه في الكيمياء العضوية هناك أنواع يتم الحفاظ عليها حتى عندما نقدم كميات متساوية من الكلور والبروم واليود بدلاً من الهيدروجين. وهذا يعني أن نظرية الاستبدال تستند إلى الحقائق ، علاوة على أنها الأكثر ذكاءً في الكيمياء العضوية. "نقلاً عن هذا المقتطف في تقريره السنوي للأكاديمية السويدية (" Jahresbericht إلخ "، المجلد 19 ، 1840 ، ص 370) ملاحظات Berzelius: "Dumas أعد مركب يعطي له الصيغة المنطقية C4Cl6O3 + H2O (الأوزان الذرية حديثة ، حمض ثلاثي كلورو أسيتيك يعتبر مركب أنهيدريد مع الماء). هذه الملاحظة يصنفها بين faits les plus eclatants de la Chimie organique ؛ هذا هو أساس نظريته في الاستبدال. والتي ، في رأيه ، ستطيح بالنظريات الكهروكيميائية ... ولكن في هذه الأثناء اتضح أن على المرء فقط كتابة صيغته بشكل مختلف قليلاً من أجل الحصول على مركب حمض الأكساليك. مع الكلوريد المقابل ، C2Cl6 + C2O4H2 ، والذي يظل متحدًا مع حمض الأكساليك في كل من الحمض والأملاح. لذلك نحن نتعامل مع نوع من المركب ، تُعرف أمثلة كثيرة منه ؛ العديد ... لكل من الجذور البسيطة والمعقدة خاصية أن الجزء المحتوي على الأكسجين يمكن أن يدخل في تركيبة مع القواعد ويفقدها دون فقد الاتصال بالجزء المحتوي على الكلور. هذا الرأي لم يقدمه دوماس ولم يخضع للتحقق التجريبي ، ولكن في غضون ذلك ، إذا كان صحيحًا ، فإن التعليم الجديد ، الذي ، وفقًا لدوماس ، يتعارض مع الأفكار النظرية التي سادت حتى الآن ، لديه يتم سحب التربة من تحت قدميها ويجب أن تسقط. ثم بعض المركبات غير العضوية ، التي تشبه ، في رأيه ، حمض الكلورو أسيتيك (فيما بينها ، استشهد برزيليوس أيضًا بكلوريد حمض الكروميك - CrO2Cl2 ، والذي اعتبره مركبًا من الكروم البركلوري ( غير معروف حتى يومنا هذا) مع أنهيدريد الكروم: 3CrO2Cl2 \ u003d CrCl6 + 2CrO3) ، يستمر Berzelius: "من الواضح أن حمض كلورو أسيتيك Dumas ينتمي إلى هذه الفئة من المركبات ؛ في ذلك ، يتم دمج جذور الكربون مع كل من الأكسجين والكلور. لذلك يمكن أن يكون حمض الأكساليك ، حيث يتم استبدال نصف الأكسجين بالكلور ، أو مركب من ذرة واحدة (جزيء) من حمض الأكساليك مع ذرة واحدة (جزيء) من سيسكويكلوريد الكربون - C2Cl6. لا يمكن قبول الافتراض الأول ، لأنه يعترف بإمكانية استبدال 11/2 ذرة أكسجين بالكلور (وفقًا لبرزيليوس ، كان حمض الأكساليك هو C2O3.). من ناحية أخرى ، يلتزم دوما بالفكرة الثالثة ، والتي تتعارض تمامًا مع المفهومين أعلاه ، والتي بموجبها لا يحل الكلور محل الأكسجين ، ولكن الهيدروجين الكهروضوئي ، مكونًا الهيدروكربون C4Cl6 ، والذي له نفس خصائص الجذور المعقدة مثل C4H6 أو أسيتيل ، ويفترض أنه قادر على إعطاء حمض بثلاث ذرات أكسجين ، متطابقة في الخصائص مع U. ، ولكن ، كما يتضح من المقارنة ( الخصائص الفيزيائية) ، مختلف تمامًا عن ذلك. "إن مدى عمق اقتناع برزيليوس في ذلك الوقت بالتكوين المختلف لحمض الأسيتيك وثلاثي كلورو أسيتيك ، يمكن رؤيته بوضوح من الملاحظة التي أدلى بها في نفس العام (" Jahresb. "، 19 ، 1840 ، 558) بخصوص مقالة جيرارد ("رحلة. ف. ف. الفصل" ، الرابع عشر ، 17): "جيرارد ، كما يقول ، أعرب نظرة جديدةعلى تكوين الكحول والأثير ومشتقاتهما ؛ هو كالتالي: مركب معروف من الكروم والأكسجين والكلور له الصيغة = CrO2Cl2 ، الكلور يحل محل ذرة الأكسجين فيه (Berzelius يعني 1 ذرة أكسجين من أنهيدريد الكروم - CrO3). يحتوي حمض U. وشغلت لعبة الصيغ هذه 37 صفحة. ولكن بالفعل العام القادمدوماس ، الذي طور فكرة الأنواع ، أشار إلى أنه ، بالحديث عن هوية خواص U و trichloroacetic acid ، كان يقصد هوية خواصها الكيميائية ، معبرًا عنها بوضوح ، على سبيل المثال ، في تشبيه انحلالها. تحت تأثير القلويات: C2H3O2K + KOH = CH4 + K2CO8 و C2Cl3O2K + KOH = CHCl3 + K2CO8 ، نظرًا لأن CH4 و CHCl3 يمثلان نفس النوع الميكانيكي. من ناحية أخرى ، تحدث ليبيج وجراهام علنًا عن البساطة الكبيرة التي تحققت على أساس نظرية الاستبدال ، عند النظر في مشتقات الكلور للإيثر العادي وإسترات الفورميك وحمض يو. لضغوط الحقائق الجديدة ، في الطبعة الخامسة. من كتابه "Lehrbuch der Chemie" (المقدمة في نوفمبر 1842) ، متناسيًا مراجعته القاسية لجيرارد ، وجد أنه من الممكن كتابة ما يلي: "إذا تذكرنا التحول (في نص التحلل) لحمض الأسيتيك تحت تأثير الكلور إلى حمض الكلوروكساليك (حمض الكلوروكساليك - كلوروكسالساور - Berzelius يسمي حمض trichloroacetic ("Lehrbuch" ، الطبعة الخامسة ، ص 629) ، ثم من الممكن رؤية أخرى لتكوين حمض الأسيتيك (يسمى حمض الأسيتيك Acetylsaure بواسطة Berzelius) ، وبالتحديد ، يمكن دمج حمض الأكساليك ، حيث تكون المجموعة المطابقة (بارلينج) هي C2H6 ، تمامًا كما أن المجموعة المطابقة في حمض الكلوروكساليك هي C2Cl6 ، ومن ثم سيتكون عمل الكلور على حمض الأسيتيك فقط في تحويل C2H6 إلى C2Cl6. . ، ومع ذلك ، من المفيد الانتباه إلى إمكانية حدوث ذلك ".
وبالتالي ، كان على Berzelius أن يعترف بإمكانية استبدال الهيدروجين بالكلور دون تغيير الوظيفة الكيميائية للجسم الأصلي الذي يتم فيه الاستبدال. دون الخوض في تطبيق آرائه على المركبات الأخرى ، أنتقل إلى أعمال كولبي ، الذي وجد عددًا من الحقائق عن حمض الأسيتيك ، ثم بالنسبة للأحماض أحادية القاعدة الأخرى ، التي كانت متوافقة مع آراء بيرزيليوس (جيرارد) . كانت نقطة البداية لعمل كولبي هي دراسة مادة بلورية ، وهي التركيبة CCl4SO2 ، التي حصل عليها بيرزيليوس ومارس سابقًا من خلال تأثير الماء الريجي على CS2 وشكلها كولبي بفعل الكلور الرطب على CS2. أظهر عدد من تحولات كولبي (انظر Kolbe ، "Beitrage znr Kenntniss der gepaarten Verbindungen" ("Ann. Ch. u. Ph."، 54 ، 1845 ، 145).) ما يمثله هذا الجسم ، متحدثًا لغة حديثة ، حمض ثلاثي كلورو ميثيل سلفونيك ، أنهيدريد الكلور ، CCl4SO2 = CCl3.SO2Cl (أطلق عليه Kolbe اسم Schwefligsaures Kohlensuperchlorid) ، قادر على إعطاء أملاح الحمض المقابل - CCl3.SO2 (OH) تحت تأثير القلويات [وفقًا لـ Kolbe HO + C2Clure3S الأوزان الذرية: H = 2 ، Cl \ u003d 71 ، C \ u003d 12 و O \ u003d 16 ؛ وبالتالي ، في الأوزان الذرية الحديثة ، يكون C4Cl6S2O6H2.) ، والتي ، تحت تأثير الزنك ، تستبدل أولاً ذرة Cl مع الهيدروجين ، الذي يشكل الحمض CHCl2.SO2 (OH) [وفقًا لـ Kolbe - wasserhaltige Chlorformylunterschwefelsaure (Berzelius ("Jahresb." 25 ، 1846 ، 91) يلاحظ أنه من الصحيح اعتباره مزيجًا من حمض الديثيونيك S2O5 مع الكلوروفورميل ، لماذا هو يدعو CCl3SO2 (OH) Kohlensuperchlorur (C2Cl6) - Dithionsaure (S2O5). الماء الرطب ، كالعادة ، Berzelius لا يؤخذ في الاعتبار.) ، ثم آخر ، مكونًا الحمض CH2Cl.SO2 (OH) [وفقًا لـ Kolbe - Chlorelaylunterschwefelsaure] ، وأخيرًا ، عند اختزال ملغم التيار أو البوتاسيوم (تم تطبيق التفاعل قبل ذلك بوقت قصير و Melsans لاستعادة حمض الخليك ثلاثي الكلور إلى حمض الأسيتيك.) يستبدل كل ذرات الكلور الثلاث بالهيدروجين ، مكونًا حمض الميثيل سلفونيك. CH3.SO2 (OH) [وفقًا لـ Kolbe - Methylunterschwefelsaure]. كان تشبيه هذه المركبات بأحماض الكلورو أسيتيك مذهلاً بشكل لا إرادي ؛ في الواقع ، مع الصيغ آنذاك ، تم الحصول على سلسلتين متوازيتين ، كما يتضح من الجدول التالي: S2O5 H2O + C2H6.C2O3 هذا لم يفلت من Kolbe ، الذي يلاحظ (I. p. 181): "إلى أحماض الكبريت مجتمعة الموصوفة أعلاه ومباشرة في حمض الكبريتات الكلوروكربونية (أعلاه - H2O + C2Cl6.S2O5) يجاور حمض الكلوروكساليك ، المعروف أيضًا باسم حمض كلورو أسيتيك. ، كما تعلم ، يتحول في الضوء تحت تأثير الكلور إلى - سداسي كلورو الإيثان (وفقًا للتسمية آنذاك - Kohlensuperchlorur) ، ويمكن توقع أنه إذا تعرض في نفس الوقت لتأثير الماء ، إذن ، مثل كلوريد البزموت ، والأنتيمون الكلور ، وما إلى ذلك ، في لحظة التكوين ، سيحل محل الكلور بالأكسجين ، وقد أكدت التجربة هذا الافتراض. تحت تأثير الضوء والكلور على C2Cl4 ، الذي كان تحت الماء ، تلقى Kolbe ، جنبًا إلى جنب مع سداسي كلورو الإيثان ، حمض trichloroacetic وعبّر عن التحول على النحو التالي: (نظرًا لأنه يمكن الحصول على C2Cl4 من CCl عن طريق تمريره عبر أنبوب ساخن) ، و CCl4 يتم تكوينه عند تسخينه ، من Cl2 إلى CS2 ، ثم يكون تفاعل Kolbe هو أول تخليق لحمض الأسيتيك من العناصر. ) "من الصعب تحديد ما إذا كان حمض الأكساليك الحر قد تم تكوينه في نفس الوقت ، حيث أن الكلور الخفيف يؤكسده فورًا في حمض الأسيتيك" ... وجهة نظر برزيليوس عن حمض الكلورو أسيتيك "بشكل مفاجئ (auf eine tiberraschende Weise) تم تأكيدها من خلال وجود والتوازي بين الخصائص المجمعة لأحماض الكبريت ، ويبدو لي (يقول Kolbe I. p. 186) أنه يتجاوز مجال الفرضيات ويكتسب بدرجة عاليةالاحتمالات. لأنه إذا كان حمض الكلوروكربونيك (Chlorkohlenoxalsaure ، كما يسميه Kolbe الآن حمض كلورو أسيتيك.) يحتوي على تركيبة مماثلة لتكوين حمض الكلوروكربونيك ، فيجب علينا أيضًا اعتبار حمض الأسيتيك ، المسؤول عن حمض الميثيل الكبريت ، كحمض مدمج ونعتبره ميثيلًا. حمض الأكساليك: C2H6.C2O3 (هذا رأي ذكره سابقًا جيرارد). ليس من غير المعقول أننا سنضطر في المستقبل إلى تناول عدد كبير من الأحماض العضوية للأحماض المركبة والتي في الوقت الحاضر ، بسبب محدودية معلوماتنا ، نقبل الجذور الافتراضية ... "" أما بالنسبة للظواهر من الاستبدال في هذه الأحماض المركبة ، ثم يتلقون تفسيرًا بسيطًا في حقيقة أن المركبات المختلفة المتشابهة على الأرجح قادرة على استبدال بعضها البعض في دور المجموعات المركبة (als Paarlinge، l. p. 187) ، دون تغيير كبير في الخصائص الحمضية لـ هيئة مدمجة معهم! "تأكيد تجريبي إضافي نجد هذا الرأي في مقالة فرانكلاند وكولبي:" Ueber die chemische Constitution der Sauren der Reihe (CH2) 2nO4 und der unter den Namen "Nitrile" bekannten Verbindungen "(" Ann. Chem . n. Pharm. "، 65، 1848، 288) بناءً على فكرة أن جميع أحماض السلسلة (CH2) 2nO4 مبنية مثل حمض ميثيلوكساليك (الآن نكتب CnH2nO2 ونسمي حمض ميثيلوكساليك - أسيتيك.) ، لاحظوا ما يلي عام: "إذا كانت الصيغة H2O + H2.C2O3 تمثل التعبير الحقيقي عن التركيب العقلاني لحمض الفورميك ، أي إذا تم اعتباره حمض أكساليك مقترنًا بمكافئ واحد للهيدروجين (التعبير غير صحيح ؛ بدلاً من H. يستخدم Frankland و Kolbe الحرف المشطوب ، والذي يعادل 2 N.) ، ثم التحويل مع درجة حرارة عاليةفورمات الأمونيوم إلى حمض الهيدروسيانيك المائي ، لأنه من المعروف والعثور على دوبرينير أن أكسالات الأمونيوم تتحلل عند تسخينها إلى ماء وسماوي. عندما يتحد حمض الفورميك ، يشارك الهيدروجين في التفاعل فقط من خلال حقيقة أنه عندما يقترن بالسماوي ، فإنه يشكل حمض الهيدروسيانيك: مع هذا الاختلاف الوحيد ؛ أنه في لحظة تكوين حمض الأكساليك يتحد مع هيدروجين حمض الهيدروسيانيك. "حقيقة أن سيانيد البنزين (C6H5CN) ، على سبيل المثال ، وفقًا لـ Fehling ، ليس له خصائص حمضية ولا يشكل العلبة الزرقاء البروسية ، وفقًا لـ Kolbe و Frankland ، بالتوازي مع عدم قدرة كلوريد الإيثيل على التفاعل مع AgNO3 ، ويثبت كولبي وفرانكلاند صحتها عن طريق التوليف باستخدام طريقة النتريل (لقد حصلوا على النتريل بتقطير أحماض الكبريتيك باستخدام KCN (بواسطة طريقة Dumas و Malagutti مع Leblanc) : R "SO3 (OH) + KCN \ u003d R. CN + KHSO4) خليك ، بروبيونيك (وفقًا لما كان في ذلك الوقت ، ميث أسيتون ،) وحمض كابرويك. ثم ، في العام التالي ، أخضع كولبي الأملاح القلوية للأحماض المشبعة أحادية القاعدة للتحليل الكهربائي ، ووفقًا لمخططه ، لوحظ في نفس الوقت ، أثناء التحليل الكهربائي لحمض الأسيتيك ، تكوين الإيثان وحمض الكربونيك والهيدروجين: H2O + C2H6.C2O3 = H2 + ، وفي التحليل الكهربائي لحمض الفاليريك - الأوكتان ، حمض الكربونيك والهيدروجين: H2O + C8H18.C2O3 = H2 +. ومع ذلك ، من المستحيل عدم ملاحظة أن كولبي توقع الحصول على الميثيل (CH3) "مقترنًا بالهيدروجين ، أي غاز المستنقعات ، من حمض الأسيتيك ، وبوتيل C4H9 من حمض الفاليريك ، جنبًا إلى جنب أيضًا مع الهيدروجين ، أي C4H10 (يسمي C4H9 فالييل) ، ولكن في هذا التوقع يجب على المرء أن يرى تنازلاً لصيغ جيرارد ، الذي حصل بالفعل على حقوق مواطنة مهمة ، والذي تخلى عن وجهة نظره السابقة لحمض الأسيتيك واعتبره ليس لـ C4H8O4 ، وهي الصيغة ، بالحكم من خلال البيانات المبردة ، تمتلكها بالفعل ، ولكن بالنسبة لـ C2H4O2 ، كما هو مكتوب في جميع كتب الكيمياء الحديثة.
من خلال أعمال كولبي ، تم أخيرًا توضيح بنية حمض الأسيتيك ، وفي الوقت نفسه جميع الأحماض العضوية الأخرى ، وتم تقليل دور الكيميائيين اللاحقين فقط إلى الانقسام - بسبب الاعتبارات النظرية وسلطة جيرارد ، صيغ كولبي في النصف. وترجمتها إلى لغة وجهات النظر الهيكلية ، والتي بسببها تحولت الصيغة C2H6.C2O4H2 إلى CH3.CO (OH).
2. خصائص حامض الخليك
الأحماض الكربوكسيلية - المركبات العضوية التي تحتوي على مجموعة أو أكثر من مجموعات الكربوكسيل -COOH ، المرتبطة بجذر الهيدروكربون.
تعود الخواص الحمضية للأحماض الكربوكسيلية إلى تحول كثافة الإلكترون إلى الأكسجين الكربوني وما ينتج عنه من استقطاب إضافي (مقارنة بالكحوليات) للرابطة О - Н.
في محلول مائي ، تتفكك الأحماض الكربوكسيلية إلى أيونات:
مع زيادة الوزن الجزيئي ، تقل قابلية ذوبان الأحماض في الماء.
وفقًا لعدد مجموعات الكربوكسيل ، يتم تقسيم الأحماض إلى أحادي (أحادي الكربوكسيل) ومتعدد القاعدة (ثنائي الكربوكسيل ، ثلاثي الكربوكسيل ، إلخ).
وفقًا لطبيعة الجذور الهيدروكربونية ، تتميز الأحماض المشبعة وغير المشبعة والعطرية.
يتم إعطاء الأسماء المنهجية للأحماض من خلال اسم الهيدروكربون المقابل مع إضافة اللاحقة -وفاياوالكلمات حامض. غالبًا ما يتم استخدام الأسماء التافهة أيضًا.
بعض الأحماض المشبعة أحادية القاعدة
الأحماض الكربوكسيلية شديدة التفاعل. تتفاعل مع مواد مختلفة وتشكل مجموعة متنوعة من المركبات ، من بينها أهمية كبيرة المشتقات الوظيفية، بمعنى آخر. المركبات الناتجة عن التفاعلات في مجموعة الكربوكسيل.
2.1 تشكيل الأملاح
أ) عند التفاعل مع المعادن:
2 ملغ + ملغ 2 ملغ + ح 2
ب) في التفاعلات مع هيدروكسيدات المعادن:
2 ركوه + هيدروكسيد الصوديوم + ركونا + ح 2 س
بدلاً من الأحماض الكربوكسيلية ، غالبًا ما تستخدم هاليداتها الحمضية:
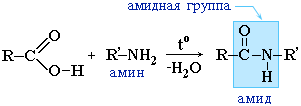 |
تتشكل الأميدات أيضًا عن طريق تفاعل الأحماض الكربوكسيلية (هاليداتها أو أنهيدريدها) مع المشتقات العضوية للأمونيا (الأمينات):
تلعب الأميدات دورًا مهمًا في الطبيعة. جزيئات الببتيدات الطبيعية والبروتينات مبنية من الأحماض الأمينية بمشاركة مجموعات الأميد - روابط الببتيد.
الخليك (حمض إيثانويك).
الصيغة: CH 3 - COOH ؛ سائل عديم اللون صافٍ برائحة نفاذة ؛ تحت نقطة الانصهار (درجة الانصهار 16.6 درجة مئوية) كتلة شبيهة بالجليد (لذلك ، يسمى حمض الأسيتيك المركز أيضًا حمض الخليك الجليدي). قابل للذوبان في الماء والإيثانول.
الجدول 1. الخصائص الفيزيائية لحمض الخليك
حمض الخليك الصناعي من الدرجة الغذائية هو سائل عديم اللون ، واضح ، قابل للاشتعال برائحة الخل القوية. يتم إنتاج حمض أسيتيك صناعي من الدرجة الغذائية من الميثانول وأول أكسيد الكربون على محفز الروديوم. يستخدم حمض الأسيتيك الصناعي من الدرجة الغذائية في المواد الكيميائية والصيدلانية و صناعة خفيفة، وكذلك في الصناعات الغذائيةكمادة حافظة. صيغة CH 3 COOH.
يتوفر حمض الأسيتيك الصناعي بدرجة الغذاء المركزة (99.7٪) وفي شكل محلول مائي (80٪).
وفقًا للمؤشرات الفيزيائية والكيميائية ، يجب أن يتوافق حمض الأسيتيك الغذائي الاصطناعي مع المعايير التالية:
الجدول 2. المتطلبات الفنية الرئيسية
| اسم المؤشر | معيار |
| 1. المظهر | عديم اللون، السائل واضحبدون شوائب ميكانيكية |
| 2. الذوبان في الماء | حل كامل وواضح |
| 3. جزء الشاملحمض الخليك ،٪ ، لا تقل عن | 99,5 |
| 4. جزء الكتلة من الأسيتالديهيد ،٪ ، لا أكثر | 0,004 |
| 5. جزء الكتلة من حمض الفورميك ،٪ ، لا أكثر | 0,05 |
| 6. الكسر الكتلي للكبريتات (SO 4) ،٪ ، لا أكثر | 0,0003 |
| 7. جزء الكتلة من الكلوريدات (Cl) ،٪ ، لا أكثر | 0,0004 |
| 8. كسر الكتلة معادن ثقيلةترسبت بواسطة كبريتيد الهيدروجين (Pb) ،٪ ، لا أكثر | 0,0004 |
| 9. جزء الكتلة من الحديد (Fe) ،٪ ، لا أكثر | 0,0004 |
| 10. جزء الكتلة من المخلفات غير المتطايرة ،٪ ، لا أكثر | 0,004 |
| 11. ثبات اللون لمحلول برمنجنات البوتاسيوم ، دقيقة ، ليس أقل | 60 |
| 12. جزء الكتلة من المواد المؤكسدة بثاني كرومات البوتاسيوم ، سم 3 محلول ثيوسلفات الصوديوم ، التركيز c (Na 2 SO 3 * 5H 2 O) \ u003d 0.1 mol / dm 3 (0.1H) ، لا أكثر | 5,0 |
حمض الخليك الغذائي الاصطناعي هو سائل قابل للاشتعال ، وفقًا لدرجة التأثير على الجسم ، فهو ينتمي إلى مواد من فئة الخطر الثالث. عند العمل بحمض الخليك ، استخدمه الوسائل الفرديةالحماية (ترشيح أقنعة الغاز). الإسعافات الأولية للحروق - غسيل غزير بالماء.
يتم سكب حمض الخليك الغذائي الاصطناعي في عربات صهريج نظيفة للسكك الحديدية ، وشاحنات صهريجية السطح الداخليمن الفولاذ المقاوم للصدأ ، إلى حاويات وحاويات وبراميل من الفولاذ المقاوم للصدأ بسعة تصل إلى 275 dm3 ، وكذلك في عبوات زجاجية وبراميل بولي إيثيلين بسعة تصل إلى 50 dm3. الحاوية البوليمرية مناسبة للخليج وتخزين حامض الخليك خلال شهر واحد. يتم تخزين حمض الأسيتيك الصناعي من الدرجة الغذائية في خزانات محكمة الغلق من الفولاذ المقاوم للصدأ. يتم تخزين الحاويات والحاويات والبراميل والزجاجات وقوارير البولي إيثيلين في المستودعات أو تحت مظلة. لا تخزن مع عوامل مؤكسدة قوية ( حمض النيتريك, حامض الكبريتيك، برمنجنات البوتاسيوم ، إلخ).
يتم نقلها في خزانات للسكك الحديدية مصنوعة من الفولاذ المقاوم للصدأ بدرجة 12X18H10T أو 10X17H13M2T ، مع تفريغ علوي.
3. الحصول على حامض الخليك
حمض الخليك هو الأهم منتج كيميائي، والتي تستخدم على نطاق واسع في الصناعة لإنتاج الإسترات ، والمونومرات (أسيتات الفينيل) ، في صناعة الأغذية ، إلخ. الإنتاج العالميتصل إلى 5 ملايين طن سنويا. حتى وقت قريب ، كان إنتاج حمض الأسيتيك يعتمد على المواد الخام البتروكيماوية. في عملية Walker ، يتأكسد الإيثيلين في ظروف معتدلة مع الأكسجين الجوي إلى أسيتالديهيد في وجود نظام تحفيزي PdCl2 و CuCl2. علاوة على ذلك ، يتأكسد الأسيتالديهيد إلى حمض الأسيتيك:
CH2 = CH2 + 1/2 O2 CH3CHO CH3COOH
وفقًا لطريقة أخرى ، يتم الحصول على حمض الأسيتيك عن طريق أكسدة البيوتان n عند درجة حرارة 200 درجة مئوية وضغط 50 ضغط جوي في وجود محفز الكوبالت.
يتم استبدال عملية Walker الرشيقة ، وهي أحد رموز تطور الكيمياء البتروكيماوية ، تدريجياً بأساليب جديدة تعتمد على استخدام المواد الخام للفحم. تم تطوير طرق لإنتاج حمض الأسيتيك من الميثانول:
CH3OH + COCH3COOH
هذا التفاعل ، الذي له أهمية صناعية كبيرة ، هو مثال ممتاز على النجاح الحفز المتجانس. نظرًا لأنه يمكن الحصول على كلا مكوني التفاعل - CH3OH و CO - من الفحم ، يجب أن تصبح عملية المعالجة بالكربونيل أكثر اقتصادية مع ارتفاع أسعار النفط. هناك عمليتان صناعيتان لكربونيل الميثانول. الطريقة الأقدم التي طورتها BASF تستخدم محفزًا من الكوبالت ، وكانت ظروف التفاعل شديدة: درجة الحرارة 250 درجة مئوية والضغط 500-700 ضغط جوي. عملية أخرى أتقنتها مونسانتو استخدمت محفزًا من الروديوم ، وتم تنفيذ التفاعل على مستوى أكثر درجات الحرارة المنخفضة(150-200 درجة مئوية) والضغط (1-40 ضغط جوي). إن تاريخ اكتشاف هذه العملية مثير للاهتمام. قام علماء الشركة بالتحقيق في التشكيل الهيدروليكي باستخدام محفزات الفوسفين من الروديوم. اقترح المدير الفني لقسم البتروكيماويات استخدام نفس المحفز لتطعيم الميثانول بالكربونيل. كانت نتائج التجارب سلبية ، ويرجع ذلك إلى صعوبة تكوين رابطة معدنية كربونية. ومع ذلك ، تذكروا محاضرة ألقاها أحد مستشاري الشركة حول الإضافة المؤكسدة السهلة ليوديد الميثيل إلى المركبات المعدنية ، قرر الباحثون إضافة محفز اليود إلى خليط التفاعل وحصلوا على نتيجة رائعة ، والتي لم يتم تصديقها في البداية. تم اكتشاف اكتشاف مماثل من قبل العلماء في الشركة المنافسة Union Carbide ، الذين تأخروا عن ذلك ببضعة أشهر فقط. تم إنشاء فريق تطوير تكنولوجيا الميثانول الكربونيلي ، بعد 5 أشهر فقط من العمل المكثف العمليات الصناعيةمونسانتو ، وبمساعدة 150 ألف طن من حمض الخليك في عام 1970. أصبحت هذه العملية نذير مجال العلوم ، والذي كان يسمى C1-chemistry.
تم التحقيق على نطاق واسع في آلية الكربونيل. يتم الحصول على يوديد الميثيل ، الضروري للتفاعل ، بواسطة المعادلة
CH3OH + HI CH3I + H2O
يمكن تمثيل الدورة التحفيزية على النحو التالي:
يضاف يوديد الميثيل بشكل مؤكسد إلى المركب ذي المستوى المربع - (I) لتشكيل معقد تنسيق سداسي II ، ثم ، نتيجة لإدخال ثاني أكسيد الكربون من خلال رابطة الميثيل الروديوم ، يتم تكوين مركب أسيتيل روديوم (III). يؤدي التخلص الاختزالي من يوديد حمض الأسيتيك إلى تجديد المحفز ، بينما ينتج عن التحلل المائي لليوديد حمض الأسيتيك.
التوليف الصناعي لحمض الخليك:
أ) أكسدة البوتان التحفيزية
2CH3 – CH2 – CH2 – CH3 + 5O2 t 4CH3COOH + 2H2O
ب) تسخين خليط من أول أكسيد الكربون (II) والميثانول على محفز تحت ضغط
CH3OH + COCH3COOH
إنتاج حامض الخليك بالتخمير (تخمير حمض الأسيتيك).
المواد الخام: السوائل المحتوية على الإيثانول (النبيذ والعصائر المخمرة) والأكسجين.
سواغ: إنزيمات بكتيريا حمض الخليك.
التفاعل الكيميائي: يتأكسد الإيثانول حفازًا حيويًا إلى حمض الأسيتيك.
CH 2 - CH - OH + O 2 CH 2 - COOH + H 2 O
المنتج الرئيسي: حمض الخليك.
4. تطبيق حامض الخليك
يستخدم حمض الخليك للحصول على المواد الطبية والعطرية ، كمذيب (على سبيل المثال ، في إنتاج خلات السليلوز) ، في شكل خل المائدة في صناعة التوابل والمخللات والأطعمة المعلبة.
يستخدم محلول مائي من حمض الأسيتيك كنكهة ومواد حافظة (توابل للطعام ، تخليل عيش الغراب ، خضروات).
تشتمل تركيبة الخل على أحماض مثل الماليك واللاكتيك والأسكوربيك والأسيتيك.
خل التفاح (4٪ حمض الخليك)
يحتوي خل التفاح على 20 عنصرًا أساسيًا المعادنوالعناصر النزرة ، وكذلك الخل ، البروبيونيك ، اللبني و حمض الستريك, سطر كاملالأنزيمات والأحماض الأمينية والألياف الغذائية القيمة مثل البوتاس والبكتين. يستخدم خل التفاح على نطاق واسع في الطبخ أطباق متنوعةوالحفظ. سارت الامور بشكل جيد مع جميع أنواع السلطات ، سواء من الخضار الطازجة أو اللحوم والأسماك. يمكن استخدامه لتتبيل اللحوم ، والخيار ، والملفوف ، والكبر ، والبقلة ، والكمأ. ومع ذلك ، في الغرب ، يشتهر خل التفاح بخل التفاح الخصائص الطبية. يتم استخدامه للارتفاع ضغط الدم، الصداع النصفي ، الربو ، الصداع ، إدمان الكحول ، الدوخة ، التهاب المفاصل ، أمراض الكلى ، ارتفاع درجة الحرارة ، الحروق ، تقرحات الفراش ، إلخ.
ينصح الأشخاص الأصحاء بتناول مشروب صحي ومنعش كل يوم: يقلب ملعقة من العسل في كوب من الماء ويضاف ملعقة واحدة. خل حمض التفاح. إذا كنت ترغب في إنقاص الوزن ، فننصحك بشرب كوب من الماء غير المحلى مع ملعقتين كبيرتين من خل التفاح في كل مرة تأكل.
يستخدم الخل على نطاق واسع في تعليب المنزل لتحضير المخللات ذات القوة المختلفة. في الطب الشعبييستخدم الخل كمضاد للحرارة غير محدد (عن طريق فرك الجلد بمحلول من الماء والخل بنسبة 3: 1) ، وكذلك للصداع باستخدام المستحضرات. من الشائع استخدام الخل لدغات الحشرات من خلال الكمادات.
من المعروف استخدام خل الكحول في التجميل. وهي إعطاء نعومة ولمعان للشعر بعد التجعيد والتلوين الدائم. للقيام بذلك ينصح بشطف الشعر بالماء الدافئ مع إضافة خل الكحول (3-4 ملاعق كبيرة من الخل لكل 1 لتر من الماء).
خل العنب (4٪ حمض الخليك)
يستخدم خل العنب على نطاق واسع من قبل كبار الطهاة ، ليس فقط في سلوفينيا ، ولكن في جميع أنحاء العالم. في سلوفينيا ، تُستخدم تقليديًا في تحضير مختلف أنواع الخضار والسلطات الموسمية (2-3 ملاعق كبيرة لكل صحن سلطة). يعطي الطبق طعمًا فريدًا وراقًا. يتناسب خل العنب أيضًا مع العديد من سلطات الأسماك وأطباق المأكولات البحرية. عند تحضير الكباب من أنواع مختلفة من اللحوم ، وخاصة من لحم الخنزير ، لا يمكن الاستغناء عن خل العنب.
يستخدم حمض الخليك أيضًا في الإنتاج أدوية.
تحتوي أقراص الأسبرين (ES) على المادة الفعالة حمض أسيتيل الساليسيليك ، وهو إستر أسيتيك حمض الصفصاف.
يتم إنتاج حمض أسيتيل الساليسيليك عن طريق تسخين حمض الساليسيليك بحمض الخليك اللامائي في وجود كمية صغيرة من حمض الكبريتيك (كمحفز).
عند تسخينها باستخدام هيدروكسيد الصوديوم (NaOH) في محلول مائي حمض أسيتيل الساليسيليكتحلل إلى ساليسيلات الصوديوم وخلات الصوديوم. عندما يتم تحمض الوسط ، يترسب حمض الساليسيليك ويمكن تحديده من خلال نقطة انصهاره (156-1600 درجة مئوية). طريقة أخرى لتحديد حمض الساليسيليك المتكون أثناء التحلل المائي هي تلوين المحلول بلون أرجواني داكن عند إضافة كلوريد الحديد (FeCl3). يتم تحويل حمض الأسيتيك الموجود في المرشح عن طريق التسخين بالإيثانول وحمض الكبريتيك إلى إيثوكسي إيثانول ، والذي يمكن التعرف عليه بسهولة من خلال رائحته المميزة. بالإضافة إلى ذلك ، يمكن التعرف على حمض أسيتيل الساليسيليك باستخدام طرق كروماتوغرافية مختلفة.
يتبلور حمض أسيتيل الساليسيليك ليشكل متعدد السطوح أحادي الميل عديم اللون أو الإبر التي طعمها حامض قليلاً. إنها مستقرة في الهواء الجاف ولكنها تتحلل تدريجياً إلى حمض الساليسيليك وحمض الخليك في البيئات الرطبة (Leeson and Mattocks ، 1958 ؛ Stempel ، 1961). المادة النقية عبارة عن مسحوق بلوري أبيض ، عديم الرائحة تقريبًا. تشير رائحة حمض الأسيتيك إلى أن المادة قد بدأت في التحلل المائي. يخضع حمض أسيتيل الساليسيليك للأسترة تحت تأثير الهيدروكسيدات القلوية ، وبيكربونات القلوية ، وكذلك في الماء المغلي.
حمض أسيتيل الساليسيليك له تأثيرات مضادة للالتهابات وخافض للحرارة ومسكن ، ويستخدم على نطاق واسع في ظروف محمومة، والصداع ، والألم العصبي ، وما إلى ذلك وكعامل مضاد للروماتيزم.
يستخدم حمض الخليك في و صناعة كيميائية(إنتاج خلات السليلوز ، والتي يتم الحصول منها على ألياف الأسيتات ، والزجاج العضوي ، والأغشية ؛ لتخليق الأصباغ والأدوية والإسترات) ، في إنتاج الأغشية غير القابلة للاحتراق ، ومنتجات العطور ، والمذيبات ، في تركيب الأصباغ ، المواد الطبيةمثل الأسبرين. تستخدم أملاح حمض الأسيتيك لمكافحة الآفات النباتية.
استنتاج
لذلك ، حمض الخليك (CH3COOH) ، وهو سائل عديم اللون قابل للاشتعال برائحة نفاذة ، قابل للذوبان في الماء بدرجة عالية. لها طعم حامض مميز ، وتوصيل الكهرباء. استخدام حمض الأسيتيك في الصناعة كبير جدًا.
يعتبر حمض الخليك المنتج في روسيا على مستوى أفضل المعايير العالمية ، ويزداد الطلب عليه في السوق العالمية ويتم تصديره إلى العديد من دول العالم.
إن إنتاج حمض الأسيتيك له عدد من المتطلبات الخاصة به ، لذلك ، هناك حاجة إلى متخصصين يتمتعون بخبرة واسعة ليس فقط في مجال الأتمتة الصناعية والتحكم في العمليات ، ولكن أيضًا مع فهم واضح للمتطلبات الخاصة لهذه الصناعة.
قائمة الأدب المستخدم
1. أرتيمينكو ، ألكسندر إيفانوفيتش. دليل مرجعي للكيمياء / A.I. أرتمينكو ، إ. تيكونوفا ، ف. رسم. - الطبعة الثانية ، المنقحة. وإضافية - م: تخرج من المدرسه، 2002. - 367 ص.
2. احمدوف ، نيل سيباتوفيتش. الكيمياء العامة وغير العضوية: كتاب مدرسي للطلاب. الكيميائية التكنولوجية متخصص. جامعات / Akhmetov NS - 4th ed. / Rev. - M: المدرسة العليا ، 2002. -743 ص.
3. بيريزين ، بوريس دميترييفيتش. دورة الكيمياء العضوية الحديثة: Proc. بدل للطلاب. الجامعات والتعليم على التكنولوجيا الكيميائية خاص / Berezin B.D.، Berezin DB-M: High School، 2001.-768 p.
4. آي جي بوليسوف ، جي إس زايتسيفا. الأحماض الكربوكسيلية ومشتقاتها (التركيب ، التفاعل ، التطبيق في التخليق العضوي). المواد المنهجيةفي الدورة العامة للكيمياء العضوية. العدد 5. موسكو 1997
5. سومر ك. تراكم المعرفة في الكيمياء. لكل. مع الألمانية ، الطبعة الثانية. - م: مير ، 1985. - 294 ص.
6. Karakhanov E.A. تخليق الغاز كبديل للنفط. I. عملية فيشر-تروبش والتوليف أوكسو // مجلة سوروس التعليمية. 1997. No. 3. S. 69-74.
7. Karavaev M.M. ، Leonov E.V. ، Popov I.G. ، Shepelev E.T. تكنولوجيا الميثانول الصناعي. م ، 1984. 239 ص.
8. الحفز في C1- الكيمياء ، إد. كايما. م ، 1983. 296 ص.
9. Reutov ، أوليغ الكسندروفيتش. الكيمياء العضوية: كتاب مدرسي للطلاب. الجامعات والتعليم فمثلا وخاصة "الكيمياء" / Reutov O.A.، Kurts A.L. بوتين K.P.-M: دار النشر بجامعة موسكو الحكومية. - 21 انظر الفصل الأول - 1999. - 560 ص.
10. السوفياتي قاموس موسوعي، الفصل. إد. صباحا. بروخوروف - موسكو ، الموسوعة السوفيتية, 1989
11. الكيمياء: دليل مرجعي ، الفصل. إد. ن. ليبرمان - سان بطرسبرج، دار النشر "الكيمياء" 1975
12. الكيمياء: كيمياء عضوية: طبعة تعليمية لعشر خلايا. متوسط المدرسة - موسكو ، التنوير ، 1993
سومر ك. تراكم المعرفة في الكيمياء. لكل. مع الألمانية ، الطبعة الثانية. - م: مير ، 1985. ص 199.
آي جي بوليسوف ، جي إس زايتسيفا. الأحماض الكربوكسيلية ومشتقاتها (التركيب ، التفاعل ، التطبيق في التخليق العضوي). المواد المنهجية في المقرر العام للكيمياء العضوية. العدد 5. موسكو 1997 ، ص .23
سومر ك. تراكم المعرفة في الكيمياء. لكل. مع الألمانية ، الطبعة الثانية. - م: مير ، 1985. س 201
Karakhanov E.A. تخليق الغاز كبديل للنفط. I. عملية فيشر-تروبش والتوليف أوكسو // مجلة سوروس التعليمية. 1997. رقم 3. S. 69
سومر ك. تراكم المعرفة في الكيمياء. لكل. مع الألمانية ، الطبعة الثانية. - م: مير ، 1985. س 258.
سومر ك. تراكم المعرفة في الكيمياء. لكل. مع الألمانية ، الطبعة الثانية. - م: مير ، 1985. س 264
مما لا شك فيه أن أكثر المذيبات المعروفة تنوعًا فيما يتعلق بالأحماض الأليفاتية أحادية القاعدة هي حمض الأسيتيك المعروف. كما أن لها أسماء أخرى: جوهر الخل أو حمض الإيثانويك. الرخص والتوافر في تركيزات مختلفة(من 3 إلى 100٪) مادة معينة، ثباته وسهولة تنظيفه ، أدى إلى حقيقة أنه اليوم هو الأفضل والأكثر علاج معروفالذي لديه القدرة على إذابة معظم المواد أصل عضويوهو طلب كبير في مجالات متنوعةالنشاط البشري.
قد يختلف تركيز حامض الخليك ، وبالتالي إمكانية استخدامه في الصناعات الفردية. وهي مقسمة إلى طعام أي خل (3-15٪) وتقني - خل (70-80٪) وثلج (100٪).
على مستوى الأسرة ، وبشكل عام ، في صناعة المواد الغذائية ، هناك طلب كبير على محلول منخفض التركيز ، حيث تبلغ نسبة حمض الأسيتيك حوالي 3-15 ٪. هم متمرسون وجبات جاهزةيستخدم في توابل عدد من المنتجات ، وهو لا غنى عنه لتعليب وتتبيل وتمليح منتجات اللحوم والأسماك ، إلخ.
اِصطِلاحِيّ حمض الخليك 70 ، شراءالتي ، على عكس الطعام ، لا يمكن العثور عليها في محل بقالة عادي ، يتم استخدامها بنشاط في الصناعة الكيميائية كمذيب ممتاز ، وكاشف كيميائي يصنع مواد أخرى ، على سبيل المثال ، الأسيتون.
غالبًا ما يستخدم جوهر الخل التقني في الطب (على سبيل المثال ، الأسبرين) ، ولب الورق (في الصباغة والطباعة) ، والطلاء والورنيش ، وعطور النسيج ، والجلود وغيرها من المجالات الصناعية. يتم استخدامه للجمع بين المواد العطرية ، وإنتاج مبيدات الأعشاب ، وإنشاء ألياف الأسيتات (الاصطناعية).
كما تعد أهمية حمض الأسيتيك في الصناعات الطبية والصيدلانية كبيرة. هذه المادة جزء لا يتجزأ من عدد من الأدوية والأدوية ، مثل أملاح حمض الأسيتيك من الرصاص والألمنيوم ، وحمض أسيتيل الساليسيليك. مجتمعة ، يتم استخدامها في علاج العديد العمليات الالتهابيةو امراض عديدة، القمل بشكل رئيسي ، تسمم كحولى، الحزاز ، التهاب الجذر ، التهاب المفاصل ، إلخ.
جوهر الخل وكذلك المذيب 646 ، السعروهو صغير أيضًا ، يمكنك شرائه تقريبًا من أي متجر للسلع المنزلية دون استثناء. يمكنك أيضًا طلبها وشرائها بسرعة عبر الإنترنت. ستكون التكلفة أرخص. هذا مفيد بشكل خاص لأولئك الذين يعملون في الصناعة ، حيث تتطلب كميات كبيرة وحيث حمض الأسيتيك ، مثل الآخرين مذيبات كيميائية، يباع في العديد من الزجاجات والبراميل لتر. لذلك ، من الأفضل شرائه من الموردين الذين أثبتوا بالفعل وجودهم وسلعهم في هذا السوق.
تمت المشاهدة: 11،857 مرة
اسم:
حمض الخليك (حمض إيثانويك) - أحادي القاعدة حمض الكربوكسيلسلسلة أليفاتية.
صيغة كيميائية:
تاريخ الافتتاح:
عُرف حمض الخليك منذ العصور القديمة ، حيث يتشكل أثناء توتر النبيذ (خل النبيذ).
لكن العلماء لم يهتموا ببنية حمض الأسيتيك وسبب حدوثه إلا بعد النشر المثير لقواعد دوماس الأساسية لاستبدال الهيدروجين بالكلور في المركبات العضوية. قبل ذلك ، سيطرت نظرية ينس جاكوب برزيليوس على الكيمياء. قام بتقسيم العناصر إلى كهربي إيجابي وكهربائي ، ونفى تمامًا استبدالي الهيدروجين والكلور ، على التوالي ، دون تغيير التركيب الكيميائيمواد.
في عمله عام 1839 ، قدم دوما تقريرًا إلى الأكاديمية السويدية كرس فيه المبادئ الأولية للقاعدة الأساسية التي صاغها للمواد العضوية ، وحمض الأسيتيك على وجه الخصوص: "في الكيمياء غير العضوية ، نسترشد بالتشابه ، نظرية مبنية على الحقائق ، كما هو معروف ، قلة ممن يتفقون مع النظريات الكهروكيميائية. في الكيمياء العضوية ، تلعب نظرية الاستبدال نفس الدور ... وربما سيُظهر المستقبل أن كلا الرأيين مرتبطان ارتباطًا وثيقًا ، وأنهما يتبعان نفس الأسباب ويمكن تعميمهما تحت نفس الاسم ".
استغرق الأمر عدة سنوات للوصول إلى هذا الاستنتاج. بدأ دوما تجاربه الأولى بدراسة حمض الأسيتيك وتحويله إلى حمض الكلورو أسيتيك. يتم استبدال الهيدروجين في هذا التفاعل بالكامل بالكلور ، بنسبة 1: 1 ، والأهم من ذلك ، دون فقدان الخصائص الكيميائية الأساسية ونسبة المادة إلى الصنف. أخيرًا أقنعت تجارب أخرى مع استبدال الهيدروجين باليود والبروم العالم بهذا.
تبين أن الاستنتاج حول الاختلاف الأساسي بين تكوين المركبات العضوية وغير العضوية كان ثوريًا.
ومع ذلك ، دافع برزيليوس عن نظريته ، وقدم مثالًا على حمض الأكساليك ، والملح الناتج عند دمجه مع الكلوريد ، مما يعني فقدان الخصائص الحمضية. يجادل في مثال كل من العضوية و المركبات غير العضويةأن الجزء الذي يحتوي على الأكسجين يمكن أن يتفاعل مع القواعد ويفقدها دون أن يفقد الاتصال بالجزء المحتوي على الكلور. هذا هو الجانب ، وفقًا للكيميائي ، هو الإغفال الرئيسي الذي قام به دوما في تجاربه منذ ذلك الحين. لم يدحض أو يؤكد هذه الحقيقة المعروفة.
من أجل شرح النتائج التي حصل عليها دوما بطريقة ما ، طرح برزيليوس الافتراض: "حمض كلورو أسيتيك لدوما ،
من الواضح أنه ينتمي إلى هذه الفئة من المركبات ؛ فيه يتم توصيل جذور الكربون
كل من الأكسجين والكلور. لذلك قد يكون حمض الأكساليك ، في
حيث يتم استبدال نصف الأكسجين بالكلور ، أو بمركب من ذرة واحدة
(جزيئات) حمض الأكساليك مع ذرة واحدة (جزيء) من سيسكي كلوريد الكربون
C2Cl6. لا يمكن قبول الافتراض الأول لأنه يعترف بذلك
إمكانية استبدال الكلور 11/2 ، ذرات الأكسجين (حسب Berzelius، oxalic
كان الحمض C2O3.). من ناحية أخرى ، يتمسك دوما بالفكرة الثالثة تمامًا
لا يتوافق مع ما سبق ، حيث لا يحل الكلور محل الأكسجين ، ولكن
هيدروجين موجب للكهرباء ، مكونًا الهيدروكربون C4Cl6 ، والذي له نفس الشيء
خصائص جذري معقد ، مثل C4H6 أو أسيتيل ، ويفترض أنها قادرة على 3
ذرات الأكسجين لإعطاء حمض مماثل في خواصه مع U. ، لكن كما ترون
من المقارنة (لخصائصها الفيزيائية) ، مختلفة تمامًا عنها "
لكن البذور التي زرعها دوما أعطت براعمها. الآن أدار العديد من العلماء ظهورهم لنظرية برزيليوس واستمروا في الابتكار. لذلك ، أثبت تشارلز فريدريك جيرارد للمرة الأولى ، خلافًا لنظرية الراديكاليين (منشئها ومُلتزم بها كان برزيليوس) ، أن الراديكاليين لا يتواجدون بشكل مستقل ، بل هم مجموعات ذرية - "بقايا" ، والتي تشكل مزيجًا منها جزيئًا . في مقالته "حول أساسيات الأحماض" عام 1851 ، طور نظرية حول الأنواع ، وفقًا لها كل مركبات كيميائيةيمكن تصنيفها على أنها مشتقات من أربعة أنواع - الهيدروجين وكلوريد الهيدروجين والماء والأمونيا. على وجه الخصوص ، كان هناك فكرة حول تشابه دستور حمض ثلاثي كلورو الخليك وحمض الخليك. في دفاعه ، يرد برزيليوس: "عبّر جيرارد عن وجهة نظر جديدة حول تكوين الكحول والأثير و
المشتقات؛ وهي كالتالي: مركب معروف من الكروم والأكسجين والكلور
الصيغة \ u003d CrO2Cl2 ، يستبدل الكلور ذرة الأكسجين الموجودة فيه (يشير إلى
ذرة الأكسجين Berzelius 1 من أنهيدريد الكروم - CrO3). حمض U. C4H6 + 3O
يحتوي على ذرتين (جزيئات) من حمض الأكساليك ، وكاملها
تم استبدال الأكسجين بالهيدروجين = C2O3 + C2H6. " لكن لعبة الأرقام هذه لم تكن لها سلطة النظرية ، وبعد عام واحد ، وجه دوما ضربة ساحقة ، وطور نظرية الأنواع ، ودرس الخصائص المماثلة لحمض الخليك ثلاثي الكلور وحمض الخليك في تفاعل التحلل ، تحت تأثير القلويات.
من ناحية أخرى ، تحدث ليبيج وجراهام علنًا لصالح
بساطة أكبر تتحقق على أساس نظرية الاستبدال ، عند النظر
الحصول على مشتقات الكلور من الأثير العادي وإسترات الفورميك وحمض يو
مالاغوتي.
Berzelius ، يخضع لضغوط الحقائق الجديدة ، في الطبعة الخامسة. له
"Lehrbuch der Chemie" (مقدمة تم وضع علامة عليها في نوفمبر 1842) ، في الصفحة 709 ،
نسي مراجعته الحادة لجيرارد ، فوجد أنه من الممكن أن يكتب ما يلي: "لو كنا
تذكر التحول (التحلل في النص) من حمض يو تحت تأثير الكلور إلى
حمض الكلوروكساليك (Chloroxalsaure - Chloroxalsaure - Berzelius calls
حمض الخليك ثلاثي الكلور. ، ثم يبدو
يمكن رؤية طريقة أخرى لتكوين حمض يو ، أي أنه يمكن دمج حمض الأكساليك ، حيث تكون المجموعة المركبة (بارلينج) هي C2H6 ، تمامًا كما أن المجموعة المركبة في حمض الكلوروكساليك هي C2Cl6 ، ومن ثم تأثير الكلور على يتكون حمض U. فقط في تحويل C2H6 إلى C2Cl6. من الواضح أنه من المستحيل تحديد ما إذا كان هذا التمثيل أكثر صحة ... ومع ذلك ، من المفيد الانتباه إلى إمكانية ذلك.
لكن في فوج أنصار نظرية الأنواع ، وصل كل شيء. كانت نقطة البداية لعمل كولبي هي دراسة مادة بلورية ، وهي التركيبة CCl4SO2 ، التي حصل عليها بيرزيليوس ومارس سابقًا من خلال تأثير الماء الريجي على CS2 وشكلها كولبي بفعل الكلور الرطب على CS2. بالقرب من التحولات ، أظهر كولبي ذلك
يمثل الجسم ، بالمصطلحات الحديثة ، الكلور أنهيدريد
حمض ثلاثي كلورو ميثيل سلفونيك ، CCl4SO2 \ u003d CCl3.SO2Cl ، والتي ، تحت تأثير القلويات ، يمكن أن تعطي أملاح الحمض المقابل - CCl3.SO2 (OH) ، والتي ، تحت تأثير الزنك ، تستبدل أولاً ذرة Cl مع الهيدروجين ، وتشكيل حمض CHCl2.SO2 (OH) الماء الرطب ، كالعادة ، من قبل Berzelius غير مقبول
في الاعتبار) ، ثم آخر ، مكونًا حمض CH2Cl.SO2 (OH) [وفقًا لـ Kolbe -
Chlorelaylunterschwefelsaure] ، وأخيرًا عند استعادته بالتيار أو البوتاسيوم
الملغم (تم تطبيق التفاعل قبل فترة وجيزة بواسطة Melsance لـ
اختزال حمض ثلاثي كلورو الخليك إلى حمض أسيتيك.) يستبدل بالهيدروجين وجميع الثلاثة
ذرة الكلور ، مكونة حمض ميثيل سلفونيك. CH3.SO2 (OH) [وفقًا لـ Kolbe -
Methylunterschwefelsaure].
تشبيه هذه المركبات بأحماض الكلورو أسيتيك
اشتعلت العين بشكل لا إرادي ؛ في الواقع ، مع الصيغتين آنذاك
سلسلة متوازية ، كما يتضح من الجدول التالي: H2O + C2Cl6.S2O5
H2O + C2Cl6.C2O3 H2O + C2H2Cl4.S2O5 H2O + C2H2Cl4.C2O3 H2O + C2H4Cl2.S2O5
H2O + C2H4Cl2.C2O3 H2O + C2H6.S2O5 H2O + C2H6.C2O3 هذا لم يفلت من Kolbe ،
الذي يلاحظ (أولا ص 181): "إلى الأحماض الكبريتية المشتركة الموصوفة أعلاه
الأحماض ومباشرة في حمض الكبريتيك الكلوروكربوني (أعلاه -
H2O + C2Cl6.S2O5) يجاور حمض الكلوروكساليك ، المعروف أيضًا باسم
حمض الكلورو أسيتيك. الكلوروكربون السائل - CCl (Cl = 71 ، C = 12 ؛ نكتب الآن
C2Cl4 هو كلورو إيثيلين.) ، ومن المعروف أنه يتم تحويله في الضوء تحت التأثير
الكلور في - سداسي كلورو الإيثان ويمكن توقع أنه إذا تعرض في نفس الوقت لتأثير الماء ، فإنه ، مثل كلوريد البزموت ، والكلور الأنتيمون ، وما إلى ذلك ، في وقت التكوين ، سيحل محل الكلور بالأكسجين. وأكدت التجربة الافتراض "تحت تأثير الضوء و
الكلور في C2Cl4 ، الذي كان تحت الماء ، تلقى Kolbe مع سداسي كلورو الإيثان
و trichloroacetic acid ويعبر عن التحول على النحو التالي: (منذ C2Cl4
يمكن الحصول عليها من CCl4 عن طريق تمريرها عبر أنبوب مسخن ، و CCl4
يتشكل بفعل ، عند التسخين ، لـ Cl2 على CS2 ، ثم كان تفاعل كولبي
أول تخليق حمض يو من العناصر.) "هل تشكلت في وقت واحد
وحمض الأكساليك الحر ، من الصعب تحديده ، لأنه في ضوء الكلور على الفور
يؤكسدها إلى حمض يو. "...
وجهة نظر برزيليوس حول حمض الكلورو أسيتيك
"بشكل مدهش (auf eine tiberraschende Weise) تم تأكيده
وجود وتوازي خصائص الأحماض الكبريتية مجتمعة ، وكما هو الحال أنا
يبدو (يقول Kolbe I. p. p. 186) ، يتجاوز عالم الفرضيات و
يكتسب درجة عالية من الاحتمالية.
تم تأكيد تنبؤاته بشأن الاكتشافات الإضافية لطبيعة الأحماض العضوية من خلال مقال كتب فيه ، بناءً على التجارب: "لا
إنه أمر لا يصدق أننا سنضطر في المستقبل إلى تناول الأحماض المركبة
عدد كبير من تلك الأحماض العضوية التي في الوقت الحاضر ، بسبب
حدود معلوماتنا - نقبل الراديكاليين الافتراضيين ... ".
إن نظرية الراديكاليين هي أيضًا سمة مميزة له ، مؤكدة ما قيل بالفعل ، ويضيف أيضًا: "أما بالنسبة لظواهر الاستبدال في هذه الأحماض مجتمعة ، فإنها تتلقى تفسيرًا بسيطًا في الظروف التي يمكن لمركبات مختلفة ، متشابهة الشكل ، أن تحل محلها. بعضها البعض في دور الجمع بين المجموعات لا يغير بشكل كبير الخصائص الحمضية للجسم مجتمعة معهم!
نجد تأكيدًا تجريبيًا إضافيًا لهذا الرأي في مقالة Frankland and Kolbe: "استنادًا إلى فكرة أن جميع أحماض السلسلة
(CH2) 2nO4 ، مبني مثل حمض الميثيل الأكساليك (نكتب الآن CnH2nO2 و
نسمي ميثيل حمض الأكساليك - الخليك. مجتمعة في
حمض الفورميك ، يشارك الهيدروجين في التفاعل فقط لأنه يتحد مع
السيانيد ، يشكل حمض الهيدروسيانيك: التكوين العكسي لحمض الفورميك من
الهيدروسيانيك تحت تأثير القلويات ليس أكثر من تكرار
التحويل المعروف للسيانيد المذاب في الماء إلى حمض الأكساليك والأمونيا ،
مع هذا الاختلاف الوحيد ؛ أنه في وقت التكوين ، يتحد حمض الأكساليك مع
حمض الهيدروسيانيك ".
حقيقة أن سيانيد البنزين (C6H5CN) ، على سبيل المثال ، وفقًا لـ Fehling ، ليس له خصائص حمضية ولا يشكل اللون الأزرق البروسي ، وفقًا لـ Kolbe و Fankland ، يمكن أن يتوازى مع عدم قدرة كلوريد الإيثيل على التفاعل مع AgNO3 ، و صحة تأشيرهم Kolbe و
يثبت فرانكلاند عن طريق التوليف وفقًا لطريقة النتريل (لقد حصلوا على النتريل
تقطير أحماض سيرنوفيك باستخدام KCN (طريقة Dumas و Malagutti مع Leblanc):
R ". SO3 (OH) + KCN \ u003d R.CN + KHSO4) U. ، بروبيونيك (وفقًا لـ met-acetone في ذلك الوقت) و
حمض الكابرويك.
ثم ، في العام التالي ، حلل كولبي قلويًا كهربائيًا
أملاح الأحماض المشبعة أحادية القاعدة ، ووفقًا لمخططه ، لوحظ في
في الوقت نفسه ، أثناء التحليل الكهربائي لحمض الخليك ، يتم تكوين الإيثان وحمض الكربونيك و
هيدروجين:
H2O + C2H6.C2O3 = H2 + ،
وفي التحليل الكهربائي للفاليريك - الأوكتان وحمض الكربونيك والهيدروجين: H2O + C8H18.C2O3 \ u003d H2 +.
أعمال كولبي هيكل حامض الخليك وفي نفس الوقت كلها
تم أخيرًا توضيح الأحماض العضوية الأخرى ودور الكيميائيين اللاحقين
تم تقليصه إلى الانقسام فقط - بسبب الاعتبارات النظرية وسلطة جيرارد ،
صيغ كولبي في النصف وترجمتها إلى لغة وجهات النظر البنيوية ،
بسبب تحول الصيغة C2H6.C2O4H2 إلى CH3.CO (OH).
طرق الحصول على:
الطريقة التقنية الرئيسية لإنتاج حمض الأسيتيك هي أكسدة الأسيتالديهيد مع الأكسجين الجوي في وجود محفزات المنغنيز.
حمض الأسيتالديهيد الخليك
الخواص الكيميائية:
التفاعل:
المعادن
حمض الخليك خلات المغنيسيوم
طلب:
يستخدم حمض الخليك على نطاق واسع في الصناعة من أجل:
- تعليب اللحوم ومنتجات الأسماك ،
- تصنيع الألياف الاصطناعية (أسيتات) ،
- إنتاج مبيدات الأعشاب ،
- تخليق المواد العطرية والمذيبات ،
- في الجلود والمنسوجات والصناعات الأخرى ،
- تستخدم على نطاق واسع أملاح حمض الخليك - أسيتات.




