أشهر الظواهر الكيميائية. الكيمياء من حولنا الكيمياء والظواهر الكيميائية في كل مكان حولنا. الطبخ هو أيضا عملية كيميائية. في الحياة اليومية ، دون معرفة ذلك ، - العرض
كاتاسونوف نيكيتا ، سافوستيانوفا إيفجينيا ، زادورينا إليزافيتا ، دميترييف إيليا ، إرماكوف بافيل
مشروع بحثي بعنوان "التفاعلات الكيميائية في الحياة اليومية"أعده مجموعة من الطلاب في الصفوف 8-9 لمؤتمر مدرسي عمل بحثي . الغايات والأهداف:
1. تحديد الأكثر استخدامًا في الحياة اليومية تفاعلات كيميائية.
2. تحليل الأدب لتأسيس الجوهرتفاعلات.
3. تعريف درجة سلامة (خطر) منتجات التفاعل للإنسان.
تحميل:
معاينة:
لاستخدام معاينة العروض التقديمية ، قم بإنشاء حساب Google (حساب) وقم بتسجيل الدخول: https://accounts.google.com
شرح الشرائح:
التفاعلات الكيميائية في حياتنا اليومية المشاركون في المشروع: 1. Evgenia Konstantinovna Savostyanova الصف التاسع 2. إليزافيتا فاديموفنا زادورينا الصف الثامن 3. بافيل إيغوريفيتش إرماكوف الصف التاسع 4. إيليا أليكسييفيتش ديميترييف الصف التاسع 5. نيكيتا سيرجيفيتش كاتاسونوف قائد الصف التاسع: إلينا أليكساندروفنا لازاريفا 2014 ميزانية البلدية مؤسسة تعليمية"متوسط مدرسة شاملةرقم 17 "
صلة الموضوع المختار في عصرنا هذا ، يعرف الملايين مواد مختلفة. يتم استخدام الكثير منهم ليس فقط في الصناعة و الزراعةولكن أيضًا في الحياة اليومية. لسوء الحظ ، ليس كل الناس لديهم معرفة كيميائية أولية حول المواد وتحولاتها. نعتقد أنه من الضروري غرس محو الأمية الكيميائية حتى من مقاعد المدرسة. لذلك ، سيكون موضوع "التفاعلات الكيميائية في حياتنا اليومية" ذا صلة.
الأهداف والغايات: 1. التعرف على التفاعلات الكيميائية الأكثر استخدامًا في الحياة اليومية. 2. تحليل الأدب لتحديد طبيعة ردود الفعل. 3. تحديد درجة سلامة (خطر) منتجات التفاعل للإنسان.
احتراق الغاز الطبيعي روسيا رائدة في احتياطيات الغاز الطبيعي وإنتاجه. لذلك ، في منازلنا ، نستخدم تفاعل احتراق الغاز الطبيعي لتوليد طاقة حرارية. الغاز الطبيعي - خليط من الغازات المتكونة في أحشاء الأرض أثناء التحلل اللاهوائي المواد العضوية. التركيب الكيميائي: الإيثان (C 2 H 6) ، البروبان (C 3 H 8) البيوتان (C 4 H 10). بالإضافة إلى المواد الأخرى غير الهيدروكربونية: الهيدروجين (H 2) ، كبريتيد الهيدروجين (H 2S) ، وثاني أكسيد الكربون (CO 2) ، والنيتروجين (N 2) ، والهيليوم (He). الجزء الرئيسي من الغاز الطبيعي هو الميثان (CH 4) - من 92 إلى 98٪. إنه غاز عديم اللون وخفيف وقابل للاشتعال وعديم الرائحة وغير قابل للذوبان في الماء تقريبًا. خليط الميثان في الهواء قابل للانفجار. تفاعل احتراق الميثان CH 4 + 2O 2 = CO 2 + 2H 2 O + Q. يحترق الميثان بلهب مزرق أو عديم اللون تقريبًا ، مطروحًا عدد كبير منحرارة (879 كيلوجول / مول). عند استخدام معدات الغاز في المنزل ، من الضروري: فحص المدخنة ، وتهوية الغرفة ، ومراقبة حالة خطوط أنابيب الغاز ، وعدم ترك معدات الغاز العاملة دون رقابة.
المباريات المحترقة مع مجموعة كبيرة من الولاعات المختلفة ، تحظى المباريات بشعبية كبيرة. ماذا يحدث عندما تضيء المباراة؟ هنا قاموا بضربها على الصناديق. كان هناك شعلة و راءحة قوية"كبريت". بدأت العملية تحت تأثير الاحتكاك. أولاً ، اشتعل الفوسفور الأحمر ، والذي كان على علبة الثقاب 4P + 5O 2 = 2P 2 O 5 مصدر الرائحة النفاذة). أشعل الرأس النار في الخشب C 6 H 10 O 5 + 6O 2 \ u003d 6CO 2 + 5H 2 O تقريبًا جميع منتجات الاحتراق ضارة بالجسم. فقط عندما يتم حرق مباراة واحدة ، يتم إطلاق كمية ضئيلة منها ، والتي ليس لها تأثير كبير على الشخص. ولكن عند استخدام المباريات كيميائيا المثقفيجب أن نتذكر أن "المباريات ليست خطرة!"
التحلل المائي للصابون في الإنتاج والحياة اليومية ، يُطلق على الصابون الخلطات التقنية للأملاح العالية الذوبان في الماء أحماض دهنيةغالبًا مع إضافة بعض المواد الأخرى التي تحتوي على عمل الغسيل. عادة ما تعتمد المخاليط على أملاح الصوديوم (نادرًا البوتاسيوم والأمونيوم) من الأحماض الدهنية المشبعة وغير المشبعة مع عدد ذرات الكربون في الجزيء من 12 إلى 18 (دهني ، نخيل ، ميريستيك ، لوريك وأوليك). غالبًا ما يشتمل الصابون أيضًا على أملاح أحماض النفثينيك والراتنج ، وأحيانًا المركبات الأخرى التي تحتوي على محاليل منظف. يتكون الصابون من قاعدة قوية و حمض ضعيف، لذلك ، يتم تحللها بسهولة: C 17 H 35 COOHa + H 2 O \ u003d C 17 H 35 COOH + NaOH بيئة التحلل المائي قلوية ، وبالتالي فإن الصابون شديد العدوانية تجاه الجلد ويؤدي استخدامها المتكرر إلى إزالة الشحوم. هناك العديد من الأنواع والعلامات التجارية للصابون ، وقبل اختيار أنسبها ، عليك تحديد نوع بشرتك. غالبًا ما تكون البشرة الدهنية لامعة بسبب عرق قويومقصورات الدهون ، وعادة ما تحتوي على مسام كبيرة. بالفعل بعد ساعتين من الغسيل على منديل يوضع على الوجه بشرة دهنيةيترك البقع. لمثل هذا الجلد ، مطلوب صابون مع تأثير تجفيف طفيف. الجلد الجاف رقيق وحساس للغاية للرياح والطقس ، وتكون المسام الموجودة فيه صغيرة ورقيقة ؛ يتشقق بسهولة لأنه ليس مرنًا بدرجة كافية. من الضروري توفير أقصى درجات الراحة والعلاج لمثل هذا الجلد ، فمن الأفضل استخدام الصابون باهظ الثمن. الجلد الطبيعيناعمة ، ناعمة ، ذات مسام متوسطة الحجم.
بيروكسيد الهيدروجين بيروكسيد الهيدروجين هو أبسط ممثل للبيروكسيدات. سائل عديم اللون ذو طعم "معدني" ، قابل للذوبان بشكل غير محدود في الماء والكحول والأثير. غالبًا ما تستخدم الأنا في الحياة اليومية كمبيض ومطهر. عندما يتحلل بيروكسيد الهيدروجين (عندما نعالج الجرح) ، يتم إطلاق الماء وغاز الأكسجين. 2H 2 O 2 \ u003d O 2 + 2H 2 O عندما لا جرعات كبيرةفي المقابل ، يتم إطلاق كمية صغيرة من الأكسجين. في الحجم الصغير ، الأكسجين النقي ليس خطيرًا ، لكن بكميات كبيرة؟ ومع وجود كمية كبيرة منه يكون الأكسجين النقي سامًا ويمكن أن يسبب شكلًا رئويًا من التسمم بالأكسجين وله تأثير ضار على الجهاز المركزي. الجهاز العصبي. ويصاحب التعرض الأول الأعراض التالية: تهيج أنسجة الرئة. قد يبدأ بتهيج خفيف في الحلق يتبعه سعال. في الحالات الشديدةقد يكون هناك حرق طويل في الصدر وسعال لا يمكن السيطرة عليه. يمكن أن يتسبب الشكل الرئوي للتسمم بالأكسجين أيضًا في انخفاض سعة الرئة وانخفاض القدرة على تبادل الغازات ، على الرغم من أن هذه المضاعفات نادرة للغاية. وتشمل أعراض التعرض الثاني (تلف الجهاز العصبي المركزي السام): اضطرابات بصرية (رؤية نفقية ، عدم القدرة على التركيز) ، ضعف السمع (رنين في الأذنين ، ظهور أصوات غريبة) ، غثيان ، تقلصات متشنجة (خاصة عضلات الوجه) ، فرط الحساسيةإلى محفز خارجيوالدوخة. لكن كل هذا ممكن فقط عند استخدام كميات كبيرة من بيروكسيد الهيدروجين ، وبيروكسيد 3 ٪ المعتاد غير قادر على ذلك.
إخماد الصودا بالخل تُستخدم عملية إخماد الصودا بالخل عند عجن العجين للكعك والفطائر. صودا الخبز عند تعرضها درجة حرارة عاليةأو البيئة الحمضية تعطي تفاعلًا متزايدًا لإطلاق ثاني أكسيد الكربون ، والذي بدوره يؤدي إلى الروعة والمسامية. CH 3 COOH + NaHCO 3 \ u003d CH 3 COONa + H 2 O + CO 2 السؤال "لإخماد الصودا أو عدم إخماد الصودا بالخل عند الخبز" أبدي مثل السؤال: "الذي جاء أولاً - الدجاجة أو البيضة . " ومع ذلك ، بعد الخوض في الأدبيات ، وقاطعت مجموعة من المواقع ، بما في ذلك المواقع الأجنبية ، توصلت إلى استنتاج مفاده أن هذه المشكلة لا تزيد عن 70-80 عامًا. من خلال اختراق العديد من الوصفات للمطبخ الروسي القديم ، لم أجد واحدة حيث تم ذكر الصودا. في السابق ، كانت المعجنات في بلدنا تعتمد في الغالب على الخميرة ، أو بدون إضافة أي معجلات ارتفاع وتخفيف على الإطلاق. لذا، صودا الخبزاخترعها الكيميائي الفرنسي لوبلان في نهاية القرن الثامن عشر. جاء هذا الاختراع إلى روسيا بعد ذلك بكثير ، بعد الحصول على طريقة جديدة لتصنيعه. بمجرد أن حصلت ربات البيوت الروسيات على منتج مثل الصودا ، بدأوا في تطبيقه واستخدامه في الطهي. لماذا تقرر إطفاء الصودا؟ نعم ، ببساطة لأن تقاليدنا في تناول كل شيء "ساخن ، ساخن" في هذه الحالة ضار فقط. الصودا السريعة في الخبز الساخنله طعم "صابوني" كريه للغاية. ما تم "تصحيحه" بإطفائه ، وهو إضافة الماء المغلي أو منتجات الألبان المخمرة إلى الصودا. للفطائر هذه الطريقةويعطي الآن نتائج جيدة جدًا. ومع ذلك ، هل يمكنك أن تتخيل ما سيحدث لعجينة الغريبة إذا صببت كوبًا من الماء المغلي فيها؟ الجواب واضح. لذلك ، تم اختراعه ليحل محل الماء المغلي أو منتجات الألبانمخفف بـ 9٪ خل أو عصير ليمون.
الخلاصة يمكننا ملاحظة العديد من التفاعلات الكيميائية ليس فقط في دروس الكيمياء ، ولكن أيضًا في الحياة اليومية. ردود الفعل هذه ليست آمنة فقط (تخضع لقواعد السلامة) ، ولكن بعضها عديم الفائدة. على سبيل المثال: إطفاء الصودا بالخل ، قد يقول أي طباخ ماهر أن هذا مضيعة للوقت. ولكن بدون تفاعلات مثل التحلل المائي والاحتراق ، ليس لدينا أي فكرة عن وجود المزيد. أثناء هذه التفاعلات الكيميائية ، يتم إطلاق الغازات. إنها آمنة (بقدر معين). استخدام مواد كيميائيةفي الحياة اليومية ، من الضروري الامتثال لأنظمة السلامة.
مصادر المعلومات 1. Kritzman، V.A.، Stanzo، V.V. قاموس موسوعيالكيميائي الشاب [نص] - م: علم أصول التدريس ، 1990. 2. Lavrova، S.A. كيمياء مسلية [نص] -M. : وايت سيتي ، 2009. 3. ريومين ، ف. الكيمياء المسلية [نص] - م: تسينتربوليجراف ، 2012. 4. كورديوموف ، ج. 1234 سؤالاً في الكيمياء [نص] - م: مير ، بينوم ، 2007. 5. Guzey، L.S.، Kuznetsov، V.N. دليل جديدفي الكيمياء [نص] -M. : Ursa Major، 1999 6. ويكيبيديا [مورد إلكتروني] - وضع الوصول: ru.wikipedia.org 7. Egorova، A.S. مدرس كيمياء [نص] -M. : Phoenix، 2007 8. الكيمياء والحياة [مورد إلكتروني] - وضع الوصول: http: //www.hij.ru 9. الكيمياء من حولنا [مورد إلكتروني] - وضع الوصول: http://interestingchem.narod.ru/chemaround.htm
وتشمل هذه الأشياء التي يمكن ملاحظتها في الحياة اليومية الإنسان المعاصر. بعضها بسيط وواضح للغاية ، ويمكن لأي شخص مشاهدتها في مطبخه ، كمثال مع تخمير الشاي.
باستخدام مثال تخمير الشاي القوي (المركز) ، يمكنك إجراء تجربة أخرى بشكل مستقل: تفتيح الشاي بشريحة من الليمون. بسبب الأحماض الموجودة في عصير ليمون، سوف يغير السائل تركيبته مرة أخرى.
ما هي الظواهر الأخرى التي يمكنك ملاحظتها في الحياة اليومية؟ على سبيل المثال ، تشمل الظواهر الكيميائية عملية احتراق الوقود في المحرك.
للتبسيط ، يمكن وصف تفاعل احتراق الوقود في المحرك على النحو التالي: الأكسجين + الوقود = الماء + ثاني أكسيد الكربون.
بشكل عام في غرفة المحرك الاحتراق الداخليهناك العديد من التفاعلات التي تشمل الوقود (الهيدروكربونات) والهواء وشرارة الاشتعال. أو بالأحرى ، ليس الوقود فقط - خليط الوقود والهواء من الهيدروكربونات والأكسجين والنيتروجين. قبل الاشتعال ، يتم ضغط الخليط وتسخينه.
يحدث احتراق الخليط في جزء من الثانية ، ونتيجة لذلك ، يتم تدمير الرابطة بين ذرات الهيدروجين والكربون. نتيجة لذلك ، يتم إطلاق كمية كبيرة من الطاقة ، مما يؤدي إلى تحريك المكبس ، وهذا - العمود المرفقي.
بعد ذلك ، تتحد ذرات الهيدروجين والكربون مع ذرات الأكسجين والماء وثاني أكسيد الكربون.
من الناحية المثالية ، يجب أن يبدو تفاعل الاحتراق الكامل كما يلي: CnH2n + 2 + (1.5n + 0.5) O2 = nCO2 + (n + 1) H2O. في الواقع ، محركات الاحتراق الداخلي ليست بهذه الكفاءة. افترض أنه إذا لم يكن الأكسجين كافيًا أثناء التفاعل ، فإن ثاني أكسيد الكربون يتشكل نتيجة التفاعل. ومع نقص الأكسجين بشكل أكبر ، يتشكل السخام (C).
يعتبر تكوين البلاك على المعادن نتيجة للأكسدة (الصدأ على الحديد ، الزنجار على النحاس ، تغميق الفضة) أيضًا من فئة الظواهر الكيميائية المنزلية.
لنأخذ الحديد كمثال. يحدث الصدأ (الأكسدة) تحت تأثير الرطوبة (رطوبة الهواء ، الاتصال المباشر بالماء). نتيجة هذه العملية هي هيدروكسيد الحديد Fe2O3 (بتعبير أدق ، Fe2O3 * H2O). يمكنك رؤيته على أنه فضفاض أو خشن أو برتقالي أو أحمر- لوحة بنيةعلى سطح المنتجات المعدنية.
مثال آخر قد يكون لوحة خضراء(الزنجار) على سطح منتجات النحاس والبرونز. يتشكل بمرور الوقت تحت تأثير الأكسجين الجوي والرطوبة: 2Cu + O2 + H2O + CO2 = Cu2CO5H2 (أو CuCO3 * Cu (OH) 2). تم العثور على كربونات النحاس الأساسية الناتجة أيضًا في الطبيعة على شكل معدن الملكيت.
ومثال آخر على تفاعل الأكسدة البطيء للمعدن في الظروف المحلية هو تكوين طبقة داكنة من كبريتيد الفضة Ag2S على سطح العناصر الفضية: المجوهرات وأدوات المائدة وما إلى ذلك.
تتحمل جسيمات الكبريت "المسؤولية" عن حدوثها ، والتي توجد على شكل كبريتيد الهيدروجين في الهواء الذي نتنفسه. يمكن أن تصبح الفضة داكنة أيضًا عند ملامستها للكبريت منتجات الطعام(البيض مثلا). يبدو التفاعل كما يلي: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
دعنا نعود إلى المطبخ. هنا يمكنك التفكير في بعض الظواهر الكيميائية الغريبة: تشكل المقياس في الغلاية أحد هذه الظواهر.
في الظروف المحلية لا توجد مادة كيميائية ماء نقي، فهو موجود دائمًا تركيز مختلفأملاح المعادن المذابة والمواد الأخرى. إذا كان الماء مشبعًا بأملاح الكالسيوم والمغنيسيوم (هيدروكربونات) ، فيطلق عليه عسر. كلما زاد تركيز الملح ، زادت صلابة الماء.
عندما يتم تسخين هذه المياه ، تتحلل هذه الأملاح إلى ثاني أكسيد الكربون وراسب غير قابل للذوبان (CaCO3 و MgCO3). يمكنك ملاحظة هذه الرواسب الصلبة من خلال النظر إلى الغلاية (وأيضًا بالنظر إلى عناصر التسخين في الغسالات وغسالات الصحون والمكاوي).
بالإضافة إلى الكالسيوم والمغنيسيوم (الذي يتكون منه مقياس الكربونات) ، يوجد الحديد أيضًا غالبًا في الماء. أثناء التفاعلات الكيميائية للتحلل المائي والأكسدة ، تتشكل الهيدروكسيدات منه.
بالمناسبة ، عندما تكون على وشك التخلص من الميزان في الغلاية ، يمكنك ملاحظة مثال آخر على الكيمياء المسلية في الحياة اليومية: عادي خل المائدةو حمض الليمون. يتم غلي غلاية بمحلول الخل / حامض الستريك والماء ، وبعد ذلك يختفي المقياس.
وبدون ظاهرة كيميائية أخرى ، لن يكون هناك فطائر وكعكات لذيذة للأم: نحن نتحدث عن إطفاء الصودا بالخل.
عندما تطفئ الأم الصودا في ملعقة بالخل ، يحدث التفاعل التالي: NaHCO3 + CH3COOH = CH3COONa + H2O + CO2. يميل ثاني أكسيد الكربون الناتج إلى ترك العجينة - وبالتالي يغير هيكلها ، مما يجعلها مسامية وفضفاضة.
بالمناسبة ، يمكنك إخبار والدتك أنه ليس من الضروري على الإطلاق إطفاء الصودا - سوف تتفاعل على أي حال عندما تدخل العجينة إلى الفرن. ومع ذلك ، فإن التفاعل سيصبح أسوأ قليلاً مما يحدث عندما يتم إخماد الصودا. ولكن عند درجة حرارة 60 درجة (ويفضل 200) ، تتحلل الصودا إلى كربونات الصوديوم والماء ونفس ثاني أكسيد الكربون. صحيح أن طعم الفطائر والكعك الجاهز قد يكون أسوأ.
قائمة الظواهر الكيميائية المنزلية ليست أقل إثارة للإعجاب من قائمة هذه الظواهر في الطبيعة. بفضلهم ، لدينا طرق (صناعة الأسفلت ظاهرة كيميائية) ، منازل (إطلاق الطوب) ، أقمشة جميلة للملابس (صباغة). إذا فكرت في الأمر ، يصبح من الواضح مدى تعدد الأوجه وإثارة اهتمام علم الكيمياء. ومقدار الفائدة التي يمكن جنيها من فهم قوانينها.
الجزء الأول
1. التغيرات التي تحدث مع الأجسام والمواد هي
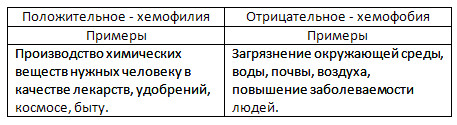
2. موقف الناس من الكيمياء.
3. صُنع الخيمياء هو حجر الفيلسوف.
هو (حدد الدور):
1) مزج الإكسير
2) الشفاء والشفاء
4. املأ جدول "الكيميائيين الروس الكبار".

الجزء الثاني
1. اختر مرادفات للمفهوم " الظواهر الكيميائية».
2) التفاعلات الكيميائية
3) الظواهر التي تتكون فيها مواد أخرى من بعض المواد
4) الظواهر التي يتغير فيها لون مادة ما أو يتشكل راسب أو غاز
2. قسّم الظواهر إلى فيزيائية (أ) وكيميائية (ب).
3. تحليل الرسومات وتسمية العملية.

أ) الاحتراق ظاهرة كيميائية
ب) يعتبر إرسال الكرة ظاهرة جسدية
ج) الانحلال ظاهرة فيزيائية
د) التبريد بالصودا - ظاهرة كيميائية
هـ) الاحتراق ظاهرة كيميائية
و) التجاذب بواسطة المغناطيس هو ظاهرة فيزيائية
إنشاء تطابق بين ظاهرة فيزيائية أو كيميائية والعملية الموضحة في الشكل.
4. تقديم عرض حول أحد الموضوعات المقترحة: "المعنى السلبي للكيمياء" أو " قيمة موجبةالكيمياء "، باستخدام الإنترنت.
5. اشطب "الإضافي":
تجميد الماء ، تبخر الماء ، غليان الماء ، تحلل الماء إلى هيدروجين وأكسجين، تنقية المياه.
6. املأ الجدول "الظواهر الفيزيائية والكيميائية" باستخدام نتائج ملاحظاتك للعمليات في الحياة اليومية وفي الطبيعة.

7. باستخدام الإنترنت ومصادر المعلومات الأخرى (المؤلفات العلمية) ، قم بتوصيل رسالة حول حياة وعمل أحد أعظم الكيميائيين الروس وفقًا للخطة التالية:
1) الطفولة.
2) الدراسة في الشباب.
3) النشاط العلمي ، الإنجازات العلمية الرئيسية.
D. I. Mendeleev - ولد في عائلة مدير وصي المدرسة ، وكان عمره 14 عامًا وكان الطفل المحبوب في الأسرة. قامت والدته بتربيته ، حيث أصيب والده بعد ولادته بفترة وجيزة بالعمى ومات. لم يكن منديليف في صالة الألعاب الرياضية يتميز باجتهاد خاص ، خاصة أنه لم يكن يحب قانون الله. أراد الدخول الأكاديمية الطبية، لكن علم الأحياء كان يفوق قوته ، وذهب إلى علم أصول التدريس.
درس جيدًا ، لكنه مرض بشدة ، ونصحه الأطباء بالتوجه جنوبًا. تعافى ودافع ببراعة عن نفسه وبدأ العمل البحثي.
1. التحقيق في ظاهرة تماثل الشكل.
2. صمم جهاز قياس ضغط الدم - جهاز لتحديد كثافة السوائل.
3. فتحت نقطة غليان السوائل ودرجة حرارتها الحرجة.
4. نشر أول كتاب مدرسي بتاريخ الكيمياء العضويةفي روسيا.
5. ابتكر نظرية الحلول الهيدرات.
6. اكتشف الجدول الدوري العناصر الكيميائية، صاغ القانون الدوري.
7. بناءً على القانون والجدول ، توقع وجود عدة عناصر كيميائية.
إرسال عملك الجيد في قاعدة المعرفة أمر بسيط. استخدم النموذج أدناه
سيكون الطلاب وطلاب الدراسات العليا والعلماء الشباب الذين يستخدمون قاعدة المعرفة في دراساتهم وعملهم ممتنين جدًا لك.
نشر على http://www.allbest.ru/
مدرسة زابوروجي الثانوية للمستويات-ІІІ 90
الظواهر الكيميائية في الحياة اليومية والحياة اليومية
طالب الصف السابع
ديمتري بالويف
مقدمة
أكسدة وقود التفاعل الكيميائي
يعيش العالم من حولنا ، بكل ثرائه وتنوعه ، وفقًا لقوانين يسهل شرحها بمساعدة علوم مثل الفيزياء والكيمياء. وحتى حياة مثل هذا الكائن المعقد كشخص لا تعتمد على أكثر من الظواهر والعمليات الكيميائية.
بالتأكيد ، لقد لاحظت أكثر من مرة شيئًا مثل حالة أمي خاتم فضييغمق بمرور الوقت. أو كيف يصدأ الأظافر. أو كيف تحترق جذوع الأشجار الخشبية وتتحول إلى رماد. ولكن حتى لو كانت والدتك لا تحب الفضة ، ولم تذهب للمشي لمسافات طويلة ، فقد رأيت بالضبط كيف يتم تحضير كيس الشاي في الكوب.
ما الذي تشترك فيه كل هذه الأمثلة؟ وحقيقة أنها كلها ظواهر كيميائية.
إذن ، الأمثلة الأكثر شيوعًا للظواهر الكيميائية في الحياة والحياة اليومية:
صدأ الأظافر
احتراق الوقود
تساقط
تخمير عصير العنب
تعفن الورق
تركيب العطور
حلق فضي غامق
ظهور اللوحة الخضراء على البرونز
تشكيل الحجم في الغلايات
اطفاء الصودا بالخل
اللحم الفاسد
حرق الورق
تريد التفاصيل؟ مثال أولي هو غلاية أضرمت فيها النار. بعد فترة ، سيبدأ الماء في التسخين ثم الغليان. سنسمع صفيرًا مميزًا ، وسوف تتطاير نفاثات البخار من عنق الغلاية. من أين أتت لأنها لم تكن أصلاً في الأطباق! نعم ، لكن الماء درجة حرارة معينة، يبدأ في التحول إلى غاز ، يغيره الحالة الفيزيائيةمن السائل إلى الغازي. أولئك. بقي الماء نفسه ، الآن فقط على شكل بخار. هذه ظاهرة فيزيائية.
وسنرى ظواهر كيميائية إذا وضعنا كيس أوراق الشاي في الماء المغلي. سيتحول لون الماء في كوب أو وعاء آخر إلى اللون البني الأحمر. سيحدث تفاعل كيميائي: تحت تأثير الحرارة ، ستبدأ أوراق الشاي بالبخار ، وتطلق أصباغ اللون و خصائص الذوقمتأصل في هذا النبات. سنحصل على مادة جديدة - مشروب بخصائص جودة محددة وفريدة من نوعها. إذا أضفنا بضع ملاعق كبيرة من السكر هناك ، فسوف يذوب (تفاعل فيزيائي) ، وسيصبح الشاي حلوًا (تفاعل كيميائي). وبالتالي ، فإن الظواهر الفيزيائية والكيميائية غالبًا ما تكون مترابطة ومترابطة. على سبيل المثال ، إذا تم وضع كيس الشاي نفسه ماء باردلن يحدث التفاعل ولن تتفاعل أوراق الشاي والماء ولن يرغب السكر في الذوبان أيضًا.
وهكذا فإن الظواهر الكيميائية هي تلك التي تتحول فيها بعض المواد إلى مواد أخرى (الماء إلى شاي ، والماء إلى شراب ، والحطب إلى رماد ، وما إلى ذلك) ، وإلا فإن الظاهرة الكيميائية تسمى تفاعل كيميائي.
يمكننا أن نحكم على ما إذا كانت الظواهر الكيميائية تحدث من خلال علامات وتغيرات معينة يتم ملاحظتها في جسم أو مادة معينة. لذلك ، فإن معظم التفاعلات الكيميائية مصحوبة بـ "علامات التعريف" التالية:
نتيجة أو أثناء سير هذه الرواسب ؛
هناك تغيير في لون المادة ؛
يمكن إطلاق الغاز ، على سبيل المثال ، أول أكسيد الكربون أثناء الاحتراق ؛
يوجد امتصاص ، أو العكس ، إطلاق للحرارة ؛
انبعاث الضوء ممكن.
من أجل ملاحظة الظواهر الكيميائية ، أي تحدث ردود الفعل ، هناك شروط معينة ضرورية:
يجب أن تكون المواد المتفاعلة على اتصال ببعضها البعض (أي يجب سكب أوراق الشاي نفسها في كوب من الماء المغلي) ؛
من الأفضل طحن المواد ، ثم سيستمر التفاعل بشكل أسرع ، وسيحدث التفاعل قريبًا (من المرجح أن تذوب رمل السكر ، وتذوب في ماء ساخنمن متكتل) ؛
حتى تحدث العديد من ردود الفعل ، تحتاج إلى التغيير نظام درجة الحرارةتتفاعل المكونات عن طريق تبريدها أو تسخينها إلى درجة حرارة معينة.
يمكنك مراقبة الظاهرة الكيميائية بشكل تجريبي. لكن لوصفها على الورق ، يمكنك استخدامها معادلة كيميائية(معادلات تفاعل كيميائي).
تعمل بعض هذه الظروف أيضًا على حدوث ظواهر فيزيائية ، على سبيل المثال ، تغيير في درجة الحرارة أو الاتصال المباشر للأشياء والأجسام ببعضها البعض. على سبيل المثال ، إذا ضربت رأس الظفر بقوة كافية بمطرقة ، فقد يتشوه ويفقد شكله المعتاد. لكنها ستبقى رأس مسمار. أو عند تشغيل المصباح الكهربائي في الشبكة ، سيبدأ خيوط التنغستن الموجودة بداخله في الاحماء والتوهج. ومع ذلك ، فإن المادة التي يصنع منها الخيط ستبقى نفس التنجستن.
لكن دعونا نلقي نظرة على بعض الأمثلة الأخرى. بعد كل شيء ، نفهم جميعًا أن الكيمياء لا تحدث فقط في أنابيب الاختبار في المختبر المدرسي.
1. الظواهر الكيميائية في الحياة اليومية
وتشمل هذه الأشياء التي يمكن ملاحظتها في الحياة اليومية للإنسان الحديث. بعضها بسيط وواضح للغاية ، ويمكن لأي شخص مشاهدتها في مطبخه ، كمثال مع تخمير الشاي.
باستخدام مثال تخمير الشاي القوي (المركز) ، يمكنك إجراء تجربة أخرى بشكل مستقل: تفتيح الشاي بشريحة من الليمون. بسبب الأحماض الموجودة في عصير الليمون ، فإن السائل سوف يغير تركيبته مرة أخرى.
ما هي الظواهر الأخرى التي يمكنك ملاحظتها في الحياة اليومية؟ على سبيل المثال ، تشمل الظواهر الكيميائية عملية احتراق الوقود في المحرك.
للتبسيط ، يمكن وصف تفاعل احتراق الوقود في المحرك على النحو التالي: الأكسجين + الوقود = الماء + ثاني أكسيد الكربون.
بشكل عام ، تحدث عدة تفاعلات في غرفة محرك الاحتراق الداخلي ، حيث يشارك فيها الوقود (الهيدروكربونات) والهواء وشرارة الاشتعال. أو بالأحرى ، ليس الوقود فقط - خليط الوقود والهواء من الهيدروكربونات والأكسجين والنيتروجين. قبل الاشتعال ، يتم ضغط الخليط وتسخينه.
يحدث احتراق الخليط في جزء من الثانية ، ونتيجة لذلك ، يتم تدمير الرابطة بين ذرات الهيدروجين والكربون. نتيجة لذلك ، يتم إطلاق كمية كبيرة من الطاقة ، مما يؤدي إلى تحريك المكبس ، وهذا - العمود المرفقي.
بعد ذلك ، تتحد ذرات الهيدروجين والكربون مع ذرات الأكسجين والماء وثاني أكسيد الكربون.
من الناحية المثالية ، يجب أن يبدو تفاعل الاحتراق الكامل كما يلي: CnH2n + 2 + (1.5n + 0.5) O2 = nCO2 + (n + 1) H2O. في الواقع ، محركات الاحتراق الداخلي ليست بهذه الكفاءة. افترض أنه إذا لم يكن الأكسجين كافيًا أثناء التفاعل ، فإن ثاني أكسيد الكربون يتشكل نتيجة التفاعل. ومع نقص الأكسجين بشكل أكبر ، يتشكل السخام (C).
يعتبر تكوين البلاك على المعادن نتيجة للأكسدة (الصدأ على الحديد ، الزنجار على النحاس ، تغميق الفضة) أيضًا من فئة الظواهر الكيميائية المنزلية.
لنأخذ الحديد كمثال. يحدث الصدأ (الأكسدة) تحت تأثير الرطوبة (رطوبة الهواء ، الاتصال المباشر بالماء). نتيجة هذه العملية هي هيدروكسيد الحديد Fe2O3 (بتعبير أدق ، Fe2O3 * H2O). قد تراه كطلاء فضفاض أو خشن أو برتقالي أو بني محمر على سطح المنتجات المعدنية.
مثال آخر هو الطلاء الأخضر (الزنجار) على سطح العناصر النحاسية والبرونزية. يتشكل بمرور الوقت تحت تأثير الأكسجين الجوي والرطوبة: 2Cu + O2 + H2O + CO2 = Cu2CO5H2 (أو CuCO3 * Cu (OH) 2). تم العثور على كربونات النحاس الأساسية الناتجة أيضًا في الطبيعة على شكل معدن الملكيت.
ومثال آخر على تفاعل الأكسدة البطيء للمعدن في الظروف المحلية هو تكوين طبقة داكنة من كبريتيد الفضة Ag2S على سطح العناصر الفضية: المجوهرات وأدوات المائدة وما إلى ذلك.
تتحمل جسيمات الكبريت "المسؤولية" عن حدوثها ، والتي توجد على شكل كبريتيد الهيدروجين في الهواء الذي نتنفسه. يمكن أن تصبح الفضة داكنة أيضًا عند ملامستها للأطعمة المحتوية على الكبريت (البيض ، على سبيل المثال). يبدو التفاعل كما يلي: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
دعنا نعود إلى المطبخ. هنا يمكنك التفكير في بعض الظواهر الكيميائية الغريبة: تشكل المقياس في الغلاية أحد هذه الظواهر.
في الظروف المنزلية ، لا يوجد ماء نقي كيميائيًا ؛ دائمًا ما تذوب فيه الأملاح المعدنية والمواد الأخرى بتركيزات مختلفة. إذا كان الماء مشبعًا بأملاح الكالسيوم والمغنيسيوم (هيدروكربونات) ، فيطلق عليه عسر. كلما زاد تركيز الملح ، زادت صلابة الماء.
عندما يتم تسخين هذه المياه ، تتحلل هذه الأملاح إلى ثاني أكسيد الكربون وراسب غير قابل للذوبان (CaCO3 و MgCO3). يمكنك ملاحظة هذه الرواسب الصلبة من خلال النظر إلى الغلاية (وأيضًا بالنظر إلى عناصر التسخين في الغسالات وغسالات الصحون والمكاوي).
بالإضافة إلى الكالسيوم والمغنيسيوم (الذي يتكون منه مقياس الكربونات) ، يوجد الحديد أيضًا غالبًا في الماء. أثناء التفاعلات الكيميائية للتحلل المائي والأكسدة ، تتشكل الهيدروكسيدات منه.
بالمناسبة ، عندما تكون على وشك التخلص من الحجم في الغلاية ، يمكنك ملاحظة مثال آخر على الكيمياء المسلية في الحياة اليومية: خل المائدة العادي وحمض الستريك يعملان بشكل جيد مع الرواسب. يتم غلي غلاية بمحلول الخل / حامض الستريك والماء ، وبعد ذلك يختفي المقياس.
وبدون ظاهرة كيميائية أخرى ، لن يكون هناك فطائر وكعكات لذيذة للأم: نحن نتحدث عن إطفاء الصودا بالخل.
عندما تطفئ الأم الصودا في ملعقة بالخل ، يحدث التفاعل التالي: NaHCO3 + CH3COOH = CH3COONa + H2O + CO2. يميل ثاني أكسيد الكربون الناتج إلى ترك العجينة - وبالتالي يغير هيكلها ، مما يجعلها مسامية وفضفاضة.
بالمناسبة ، يمكنك إخبار والدتك أنه ليس من الضروري على الإطلاق إطفاء الصودا - سوف تتفاعل على أي حال عندما تدخل العجينة إلى الفرن. ومع ذلك ، فإن التفاعل سيصبح أسوأ قليلاً مما يحدث عندما يتم إخماد الصودا. ولكن عند درجة حرارة 60 درجة (ويفضل 200) ، تتحلل الصودا إلى كربونات الصوديوم والماء ونفس ثاني أكسيد الكربون. صحيح أن طعم الفطائر والكعك الجاهز قد يكون أسوأ.
قائمة الظواهر الكيميائية المنزلية ليست أقل إثارة للإعجاب من قائمة هذه الظواهر في الطبيعة. بفضلهم ، لدينا طرق (صناعة الأسفلت ظاهرة كيميائية) ، منازل (إطلاق الطوب) ، أقمشة جميلة للملابس (صباغة). إذا فكرت في الأمر ، يصبح من الواضح مدى تعدد الأوجه وإثارة اهتمام علم الكيمياء. ومقدار الفائدة التي يمكن جنيها من فهم قوانينها.
2. ظواهر كيميائية مثيرة للاهتمام
أود أن أضيف بعض الأشياء الممتعة. من بين الظواهر العديدة التي اخترعتها الطبيعة والإنسان ، هناك ظواهر خاصة يصعب وصفها وتفسيرها. وتشمل حرق الماء. كيف يكون هذا لأن الماء لا يحترق يطفئ النار؟ كيف تحترق؟ وهذا هو الشيء.
احتراق الماء هو ظاهرة كيميائية تتكسر فيها روابط الأكسجين والهيدروجين في الماء بمزيج من الأملاح تحت تأثير موجات الراديو. والنتيجة هي الأكسجين والهيدروجين. وبالطبع ، ليس الماء نفسه هو الذي يحترق ، بل الهيدروجين.
في الوقت نفسه ، تصل درجة حرارة الاحتراق إلى درجة حرارة عالية جدًا (أكثر من ألف ونصف درجة) ، بالإضافة إلى تكوين الماء مرة أخرى أثناء التفاعل.
لطالما كانت هذه الظاهرة محل اهتمام العلماء الذين يحلمون بتعلم كيفية استخدام الماء كوقود. على سبيل المثال ، للسيارات. حتى الآن ، هذا شيء من عالم الخيال ، لكن من يدري ما سيتمكن العلماء من اختراعه قريبًا جدًا. تتمثل إحدى العقبات الرئيسية في أنه عندما يحترق الماء ، يتم إطلاق طاقة أكثر مما ينفق على التفاعل.
بالمناسبة ، يمكن ملاحظة شيء مشابه في الطبيعة. وفقًا لإحدى النظريات ، فإن الموجات المفردة الكبيرة ، التي تظهر من العدم ، هي في الواقع نتيجة لانفجار الهيدروجين. يتم إجراء التحليل الكهربائي للماء ، الذي يؤدي إليه ، بسبب دخول التصريفات الكهربائية (البرق) على سطح المياه المالحة للبحار والمحيطات.
ولكن ليس فقط في الماء ، ولكن أيضًا على الأرض ، يمكن للمرء أن يلاحظ ظواهر كيميائية مذهلة. إذا أتيحت لك الفرصة لزيارة كهف طبيعي ، فبالتأكيد ستكون قادرًا على رؤية "رقاقات ثلجية" غريبة وطبيعية تتدلى من السقف - مقرنصات. كيف ولماذا يتم تفسيرها من خلال ظاهرة كيميائية أخرى مثيرة للاهتمام.
الكيميائي ، الذي ينظر إلى الهوابط ، لا يرى ، بالطبع ، جليدًا جليديًا ، ولكن كربونات الكالسيوم CaCO3. أساس تكوينه هو مياه الصرف الصحي والحجر الجيري الطبيعي ، وقد تم بناء الهوابط نفسها بسبب ترسيب كربونات الكالسيوم (النمو الهابط) وقوة التصاق الذرات في شعرية الكريستال(النمو في الاتساع).
بالمناسبة ، يمكن أن ترتفع تشكيلات مماثلة من الأرض إلى السقف - يطلق عليهم الصواعد. وإذا اجتمعت الهوابط والصواعد واندمجت في أعمدة صلبة ، فإنها تسمى الركود.
استنتاج
تحدث العديد من الظواهر الكيميائية المدهشة والجميلة والخطيرة والمخيفة في العالم كل يوم. من الكثيرين ، تعلم الناس الاستفادة: فهم يصنعون مواد البناء ، ويطبخون الطعام ، ويجعلون المركبات تسافر لمسافات طويلة ، وأكثر من ذلك بكثير.
بدون العديد من الظواهر الكيميائية ، لم يكن وجود الحياة على الأرض ممكنًا: بدون طبقة الأوزون ، لم يكن الناس والحيوانات والنباتات على قيد الحياة بسبب الأشعة فوق البنفسجية. بدون التمثيل الضوئي للنبات ، لن يكون لدى الحيوانات والبشر ما يتنفسه ، وبدون التفاعلات الكيميائية للتنفس ، لن تكون هذه المشكلة ذات صلة على الإطلاق.
التخمير يجعل من الممكن طهي الطعام ، والظاهرة الكيميائية المماثلة للتعفن تحلل البروتينات إلى مركبات أبسط وتعيدها إلى دورة المواد في الطبيعة.
يعتبر تكوين الأكسيد عند تسخين النحاس ، مصحوبًا بتوهج لامع ، وحرق المغنيسيوم ، وذوبان السكر ، وما إلى ذلك ، من الظواهر الكيميائية أيضًا. وتجد لهم فائدة مفيدة.
استضافت على Allbest.ru
...وثائق مماثلة
مشكلة الخسائر في الأرواح في الحرائق هي مصدر قلق خاص. تعريف السلامة من الحرائق ، الوظائف الرئيسية للنظام لتوفيرها. أسباب الحرائق في العمل ومصادرها. السلامة من الحرائق في المنزل. تدابير الوقاية من الحرائق.
الملخص ، تمت الإضافة في 02/16/2009
أسباب الحرائق في المنزل وقواعد السلامة من الحرائق الأساسية. قواعد التعامل مع أجهزة الغاز والغاز. يعد التدخين في السرير أحد الأسباب الرئيسية للحرائق في الشقق. إجراءات إطفاء الحرائق وإخلاء الأشخاص والممتلكات قبل وصول رجال الإطفاء.
الملخص ، تمت الإضافة 01/24/2011
جوهر الضمان النفسي والجسدي والاجتماعي للطفل. قواعد السلوك الآمن للأطفال في المنزل ، حركة المرورالمشاة والركاب عربة. طرق تكوين موقف حذر تجاه المواقف التي يحتمل أن تكون خطرة.
ورقة مصطلح ، تمت إضافة 10/24/2014
مفهوم الظواهر الخطيرة اجتماعيا وأسباب حدوثها. الفقر هو نتيجة لتدهور مستوى المعيشة. الجوع نتيجة نقص الغذاء. تجريم المجتمع والكارثة الاجتماعية. طرق الحماية من الظواهر الاجتماعية الخطيرة.
التحكم في العمل ، تمت إضافة 02/05/2013
النظر في سمات تطور الحرائق ، بدءًا من مرحلة الاحتراق المشتعل. العلامات الرئيسية للحريق من مصدر اشتعال منخفض الطاقة. دراسة نسخة حدوث حريق نتيجة عمليات الاحتراق العفوي.
عرض تقديمي ، تمت إضافة 09/26/2014
الإصابة الكهربائية في العمل والمنزل. تأثير التيار الكهربائي على جسم الإنسان. إصابة كهربائية. اهزم الظروف صدمة كهربائية. الطرق الفنية ووسائل السلامة الكهربائية. تحسين الحماية في شبكات التوزيع.
الملخص ، تمت الإضافة في 01/04/2009
أسباب و العواقب المحتملةحرائق. العوامل الرئيسية المؤذية: الاحتراق ، الاشتعال ، الاشتعال. طرق اطفاء الحريق. تصنيف وسائل وخصائص عوامل الإطفاء. تدابير السلامة الأساسية من الحرائق في الحياة اليومية والإسعافات الأولية.
الملخص ، تمت الإضافة بتاريخ 04/04/2009
تعريف بمفهوم الخطورة وأنواعها الظواهر الهيدرولوجية. التعرف على تاريخ أفظع الفيضانات. وصف العمل المدمر لتسونامي. أسباب وعواقب كارثة علم الأحياء. آلية تشكيل وقوة التدفقات الطينية.
عرض تقديمي ، تمت إضافة 10/22/2015
أسباب الحروق الكيميائية ودرجاتها وعلاماتها الرئيسية. ملامح الحروق الكيميائية في العين والمريء والمعدة. قواعد العمل مع الأحماض والقلويات. الإسعافات الأولية عند الاستلام حرق كيميائي. تدابير لمنع الحروق الكيميائية.
الاختبار ، تمت إضافة 05/14/2015
أنواع الحوادث المحلية مع مميتأسباب حدوثها. التسمم بالمنظفات و المنظفات، إسعافات أولية. تحذير تسمم غذائي. تسرب غاز في الشقة. المواد المسببة للتآكل والسوائل المغلية. تدابير لمنع الحروق.




