التفاعلات الكيميائية للبروتينات مع المعادلات. تفاعلات اللون للبروتينات
القسم 1. تركيب وخصائص ووظائف البروتينات
الموضوع 1.1. هيكل وتصنيف الأحماض الأمينية. بنية البروتينات 6
الموضوع 1.2. التركيب والخصائص الفيزيائية والكيميائية للبروتينات 11
الموضوع 1.3. تصنيف البروتينات. بنية ووظيفة البروتينات في الجسم. بروتينات معقدة 16
عناصر الاختبار 19
دراسات الحالة 21
القسم 2. تركيب الفيتامينات وتصنيفها ودورها
الموضوع 2.1. الفيتامينات التي تذوب في الدهون 22
الموضوع 2.2. الفيتامينات القابلة للذوبان في الماء 27
عناصر الاختبار 34
دراسات الحالة 35
القسم 3. علم الإنزيمات
الموضوع 3.1. تركيب وخصائص الانزيمات. تنظيم نشاط الانزيم 36
الموضوع 3.2. تصنيف وتسمية الإنزيمات. 45- استعمال الإنزيمات في الطب
بنود الاختبار 48
دراسات الحالة 49
القسم 4. الأكسدة البيولوجية
الموضوع 4.1. المسارات الشائعة للتقويض: نزع الكربوكسيل المؤكسد من البيروفات. دورة حمض الكربوكسيل. إنزيمات السلسلة التنفسية. الفسفرة المؤكسدة (ندوة) 54
بنود الاختبار 56
دراسات الحالة 57
القسم 5. استقلاب الأحماض الأمينية والبروتينات
الموضوع 5.1. التمثيل الغذائي للبروتين الخارجي 58
الموضوع 5.2. تبادل الأحماض الأمينية داخل الخلايا 67
الموضوع 5.3. طرق تحويل الأمونيا وتحييدها 71
الموضوع 5.4. ملامح واضطرابات التمثيل الغذائي لبعض الأحماض الأمينية 76
عناصر الاختبار 82
83- إخلاء السبيل
القسم 6. التركيب والتمثيل الغذائي للنيوكليوتيدات البيورين والبيريميدين
الموضوع 6.1. هيكل واستقلاب النيوكليوتيدات البيورين والبيريميدين 84
عناصر الاختبار 90
دراسات الحالة 91
القسم 7. مصفوفة التخليق الحيوي
الموضوع 7.1. تخليق الحمض النووي وتنظيمه 92
الموضوع 7.2. 95- تركيب البروتينات
عناصر الاختبار 102
104- حفظ المعلومات
أسئلة التحكم للدرس الأخير
القسم 8. تركيب واستقلاب الكربوهيدرات
الموضوع 8.1. الهيكل والتمثيل الغذائي الخارجي للكربوهيدرات. 109- معالجة الجليكوجين
الموضوع 8.2. أكسدة الجلوكوز تحت الظروف اللاهوائية. استحداث السكر 115
الموضوع 8.3. أكسدة الجلوكوز الهوائية. مسار فوسفات البنتوز 122
عناصر الاختبار 128
129ـ الجراح
أسئلة التحكم للدرس الأخير
القسم 9. هيكل واستقلاب الدهون
الموضوع 9.1. الهيكل والتمثيل الغذائي الخارجي للدهون 134
الموضوع 9.2. التبادل داخل الخلايا أحماض دهنيةو ثلاثي الجلسرين 140
الموضوع 9.3. التمثيل الغذائي داخل الخلايا للفوسفوليبيدات والكوليسترول. نقل الدهون في الدم 147
عناصر الاختبار 150
152ـ الإبتكار
أسئلة التحكم للدرس الأخير
القسم 10. التنظيم الهرموني لعملية التمثيل الغذائي ووظائف الجسم
الموضوع 10.1. آليات نقل الإشارات الهرمونية. تصنيف الهرمونات. هرمونات الغدة النخامية. (ندوة) 157
الموضوع 10.2. هرمونات ما تحت المهاد والغدة النخامية والغدة الدرقية
البنكرياس و الغدة الدرقية 159
الموضوع 10.3. 164- هرمونات الغدة النخامية والكظرية والجنسية
عناصر الاختبار 168
169- إبراء الذمة
المادة 11. الكيمياء الحيوية للدم
الموضوع 11.1. مواد الدم المحتوية على النيتروجين: البروتينات والإنزيمات وكسور النيتروجين المتبقي 170
الموضوع 11.2. تبادل الحديد. البروتينات الدموية. تخليق وتدهور الهيم 182
الموضوع 11.3. لا المواد العضويةالدم. حمض القاعدة
الشرط 190
عناصر الاختبار 201
المهام الظرفية 202
القسم 12. الكيمياء الحيوية للكلى والكبد
الموضوع 12.1. تبادل الماء والملح. المكونات الطبيعية والمرضية للبول 204
الموضوع 12.2. مشاركة الكبد في استقلاب المواد. 214- مسعود
عناصر الاختبار 218
220ـ
أسئلة التحكم للدرس الأخير
المرفقات 1
تصنيف وتسمية الإنزيمات 226
الملحق 2
240- بروتينات بلازما الدم الفردية
الملحق 3
القيم الطبيعية للدراسة المعلمات البيوكيميائية 246
الملحق 4
عينة من الإجابات على مهام الاختبار 250
عينة من الإجابات على المهام الظرفية 252
القسم 1.
هيكل وخصائص ووظائف البروتينات
الموضوع 1.1.
هيكل وتصنيف الأحماض الأمينية.
هيكل البروتينات
ملاءمة
الأحماض الأمينية هي مادة لبناء البروتينات - المادة البلاستيكية لخلايا الكائن الحي. تعود خصائص تكوين الأحماض الأمينية إلى التنوع الهائل في بنية ووظائف جزيئات البروتين ، والتي تلعب البروتينات بسببها دورًا رائدًا في جميع عمليات الحياة. تشارك الأحماض الأمينية في تكوين الأمينات الحيوية ، والقواعد النيتروجينية ، والنيوكليوتيدات ، والناقلات العصبية ، إلخ. بعضها يستخدم كأدوية.
استهداف
التعرف على التركيب والخصائص الفيزيائية والكيميائية وتصنيف الأحماض الأمينية التي تتكون منها بروتينات جسم الإنسان.
اكتساب المهارات العملية في إجراء التحليل النوعي للسوائل البيولوجية لوجود الأحماض الأمينية والببتيدات والبروتينات باستخدام تفاعلات الألوان.
أسئلة للدراسة الذاتية
مبادئ تصنيف الأحماض الأمينية.
فئات الأحماض الأمينية:
س من دور بيولوجي(قابل للاستبدال ولا يمكن الاستغناء عنه) ؛
o وفقًا للخصائص الفيزيائية والكيميائية (محايدة ، حمضية ، قاعدية ، كارهة للماء ، محبة للماء) ؛
س من التركيب الكيميائي(مع الجذور الأليفاتية ، مع مجموعة وظيفية إضافية ، مع الجذور العطرية والحلقية غير المتجانسة ، والأحماض الأمينية) ؛
o عن طريق الذوبان في الماء (غير قطبي ، قطبي غير مشحون ، قطبي سالب وإيجابي).
الصيغ الهيكلية للأحماض الأمينية البروتينية.
الخصائص الفيزيوكيميائيةالأحماض الأمينية ، دور مجموعاتها الوظيفية.
النقطة الكهروضوئية للأحماض الأمينية والببتيدات. على ماذا تعتمد؟
تأثير تغير الأس الهيدروجيني على شحنة الأحماض الأمينية.
رابطة الببتيد ، تفاعل التكوين. خصائص رابطة الببتيد.
تأثير تغير الأس الهيدروجيني على شحنة الببتيدات وقابليتها للذوبان.
التفاعلات النوعية اللونية للأحماض الأمينية والبروتينات. مبدأ الأساليب. الاستخدام العمليتفاعلات.
الكشف عن البروتين والأحماض الأمينية الحرة في المواد البيولوجية. النقاط الرئيسيةالتحليلات. كيف تزيل البروتين من السائل البيولوجي؟ كيف تكتشف وجود الأحماض الأمينية الحرة في السائل؟
معمل 1
التفاعلات النوعية اللونية للبروتين والأحماض الأمينية
الكواشف
1) 1% بيضة صبروتين ، 2) 0.5٪ محلول نينهيدرين ، 3) 30٪ محلول هيدروكسيد الصوديوم ، 4) 10٪ محلول هيدروكسيد الصوديوم ، 5) 5٪ Pb (CH 3 COO) محلول 2 ، 6) محلول 5٪ من نتروبروسيد الصوديوم ، 7) conc. HNO 3، 8) 5٪ محلول CuSO 4.
مواد بحثية
عند دراسة تفاعلات الألوان ، يتم استخدام محلول مائي بنسبة 1٪ كهدف للدراسة. بياض البيضةتحتوي على مجموعة كاملة من الأحماض الأمينية.
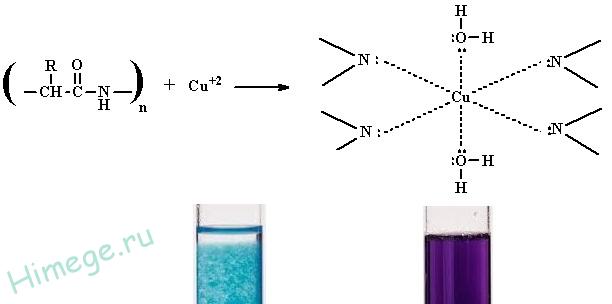
تفاعل السندات الببتيدية
للكشف عن رابطة الببتيد في البروتينات والببتيدات ، عالمي تفاعل بيوريت. يتم إعطاء تفاعل البيوريت بواسطة مواد تحتوي على مجموعتين من الببتيد على الأقل.
مبدأ
تشكل مجموعة الببتيد مركبًا معقدًا في بيئة قلوية مع أيونات النحاس 2+ ليلكيمع صبغة حمراء أو زرقاء حسب عدد روابط الببتيد. تتناسب شدة التلوين مع عدد مجموعات الببتيد.
إجراء تحليل
في أنبوب اختبار يحتوي على 5 قطرات من محلول بروتين 1٪ أضف 3 قطرات من 10٪ محلول هيدروكسيد الصوديوم وقطرة واحدة من 5٪ محلول CuSO4.
رد فعل للكشف عن مجموعات ‑ amino
للكشف عن المجموعات الأمينية الموجودة في الأحماض الأمينية والمجموعات الأمينية الطرفية من الببتيدات والبروتينات ، يتم استخدامه تفاعل النينهيدرين.
مبدأ
عندما يتم تسخين الأحماض الأمينية والببتيدات باستخدام النينهيدرين ، يحدث الانقسام التأكسدي لمجموعات الأمينية والحد من النينهيدرين. يتفاعل النينهيدرين المختزل مع الأمونيا وجزيء نينهيدرين مؤكسد آخر لتكوين مركب أزرق بنفسجي.
إجراء تحليل
يتم خلط 5 قطرات من محلول البروتين مع 5 قطرات من محلول نينهيدرين 0.5٪. يتم تسخين الأنابيب وغليها حتى يظهر لون أزرق بنفسجي.
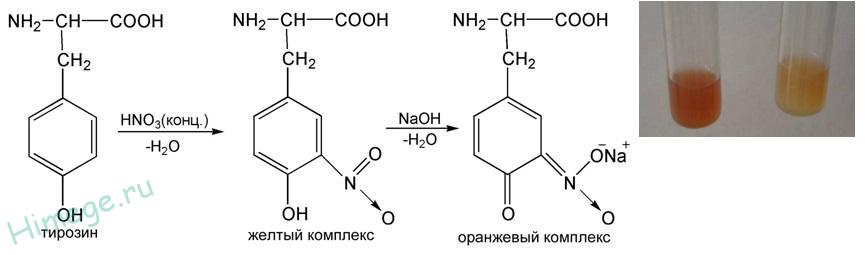
الاستجابة للأحماض الأمينية العطرية
تم الكشف عن الأحماض الأمينية العطرية (فينيل ألانين ، التيروزين ، التربتوفان) باستخدام تفاعل البروتين xantoprotein.
مبدأ
الحلقة العطرية عند التفاعل مع المركز حمض النيتريكيشكل مركب دينيترو أصفر.
إجراء تحليل
إلى 5 قطرات من محلول بروتين 1٪ أضف قطرتين من HNO 3 وسخنه برفق. لاحظ ظهور اللون الأصفر ، في حالة عدم وجود اللون الأصفر ، أضف 1-2 قطرات من HNO 3. عند إضافة فائض من محلول هيدروكسيد الصوديوم بنسبة 30٪ ، يتغير اللون إلى اللون البرتقالي.
ردود الفعل على الأحماض الأمينية المحتوية على الكبريت
مبدأ
تخضع مجموعات الكبريتيد في البروتين أو الببتيد للتحلل المائي القلوي ، مما يؤدي إلى التخلص من الكبريت على شكل كبريتيد الصوديوم Na 2 S ، والذي يدخل في تفاعلات أخرى:
ا تفاعل Fohl- Na 2 S مع أسيتات الرصاص Pb (CH 3 COO) 2 يعطي راسب أسود أو بني من كبريتيد الرصاص ؛
ا تفاعل مع نيتروبروسيد- Na 2 S يعطي مركب أحمر بني اللون مع نتروبروسيد الصوديوم.
إجراء تحليل
اغلي 5 قطرات من محلول بروتين 1٪ و 5 قطرات من 30٪ محلول هيدروكسيد الصوديوم لمدة 1-2 دقيقة. قسّم المحتويات إلى جزأين للتفاعلات "أ" و "ب".
أ) تفاعل Fohl
إلى 5 قطرات من التحلل المائي ، أضف قطرة واحدة من محلول أسيتات الرصاص وقم بالتسخين حتى يغلي. لاحظ ظهور ترسبات بنية أو سوداء.
ب) تفاعل مع نيتروبروسيد
أضف إلى 5 قطرات من التحلل المائي 2-3 قطرات من محلول نتروبروسيد الصوديوم بنسبة 5٪. لاحظ مظهر اللون الأحمر والبني.
| المواد قيد الدراسة | تلوين المنتج | مجموعة الاستجابة |
| تفاعل بيوريت | ||
| ماء | ||
| الكازين | ||
| بياض البيضة | ||
| الجيلاتين | ||
| حمض أميني | ||
| تفاعل نينهيدرين | ||
| ماء | ||
| الكازين | ||
| بياض البيضة | ||
| الجيلاتين | ||
| حمض أميني | ||
| تفاعل البروتين xantoprotein | ||
| الكازين | ||
| بياض البيضة | ||
| الجيلاتين | ||
| الفينول | ||
| تفاعل الفوهل (للكبريت غير المحكم) | ||
| ماء | ||
| الكازين | ||
| بياض البيضة | ||
| الجيلاتين |
تفاعل النينهيدرين. في هذا التفاعل ، تعطي محاليل البروتين والببتيدات والببتيدات والأحماض الأمينية الحرة ، عند تسخينها باستخدام النينهيدرين ، لونًا أزرق أو أزرق بنفسجي أو وردي بنفسجي. يتطور اللون في هذا التفاعل بسبب مجموعة α-amino. يستمر التفاعل على مرحلتين.
يُكوِّن النينهيدرين مركبات تحتوي على أحماض أمينية برابطة مزدوجة بين الكربون والنيتروجين ، تسمى إيمينات أو قواعد شيف.
|
|
تتفاعل الأحماض الأمينية ألفا بسهولة شديدة مع النينهيدرين. إلى جانبهم ، يتكون Rueman's blue-Violet أيضًا من البروتينات والببتيدات والأمينات الأولية والأمونيا وبعض المركبات الأخرى. الأمينات الثانوية ، مثل البرولين والهيدروكسي برولين ، تعطي لونًا أصفر.
يستخدم تفاعل النينهيدرين على نطاق واسع للكشف عن و تحديد الكمياتأحماض أمينية.
تقدم. خذ خمسة أنابيب اختبار ، وأضف 1 مل لكل منها: في الماء الأول ، في الثانية - محلول الكازين ، في الثالث - محلول بياض البيض ، في الرابع - محلول الجيلاتين ، في الخامس - حمض أميني (جلايسين) ) المحلول. بعد ذلك ، يتم إضافة 10-12 نقطة من محلول مع جزء كتلي من نينهيدرين في الأسيتون أو الإيثانول بنسبة 1٪ لكل أنبوب اختبار. امزج محتويات كل أنبوب عن طريق رجها ووضعها في الماء المغلي. حمام الماءلمدة 3-5 دقائق. اكتب كيمياء التفاعل ، مخطط إجراء التجربة ، بنية المركبات الملونة. يتم إدخال النتائج في الجدول. واحد.
تفاعل XANTOPROTEIN. يشير هذا التفاعل إلى وجود بقايا الأحماض الأمينية العطرية في البروتينات - التيروزين ، فينيل ألانين ، التربتوفان. يعتمد على نترات حلقة البنزين لجذور هذه الأحماض الأمينية مع تكوين مركبات النيترو الملونة في الأصفر(اليونانية "Xanthos" - أصفر). باستخدام التيروزين كمثال ، يمكن وصف هذا التفاعل في شكل المعادلات التالية.
 |
تيروسين نيتروتيروسين
|
في بيئة قلوية ، تشكل مشتقات النيترو للأحماض الأمينية أملاح بنية الكينويد ، ملونة في لون برتقالي.
يتم إنتاج تفاعل البروتين xantoprotein بواسطة البنزين ومثيلاته ، الفينول والمركبات العطرية الأخرى.
تقدم. خذ أربعة أنابيب اختبار وأضف 1 مل لكل منها: في محلول الكازين الأول ، في الثاني - محلول بياض البيض ، في الثالث - محلول الجيلاتين ، في محلول الفينول الرابع. أضف 10 قطرات من حمض النيتريك المركز إلى جميع أنابيب الاختبار. يتم خلط المحتويات بالهز وتوضع الأنابيب في حمام مائي مغلي لمدة 5-8 دقائق. تحت تأثير الحمض ، يظهر راسب بروتين يتحول إلى اللون الأصفر عند تسخينه. بعد الحمام ، يتم الاحتفاظ بالأنابيب في درجة حرارة الغرفة 4-5 دقائق وتسجيل لون المحتوى. بعد ذلك ، يضاف 1 مل من محلول مع جزء كتلي من هيدروكسيد الصوديوم 30٪ (أو قلوي آخر) إلى كل أنبوب اختبار. يتم خلط محتويات الأنابيب بالاهتزاز ، ويتم تسجيل اللون. تم وضع العمل وفقًا للجدول 1.
تفاعل FOHL (للكبريت ضعيف الترابط). يفتح هذا التفاعل جذور السيستين في البروتينات التي تحتوي على مجموعات جذرية حرة- SH (ثيول) والمجموعات المؤكسدة مع تكوين روابط ثنائي كبريتيد السيستين (-S-S-).
عندما يتم تسخين بروتين يحتوي على السيستين وبقايا السيستين في الجزيء بمحلول مركّز من القلويات والأسيتات (أو ملح آخر قابل للذوبان) من الرصاص (كاشف Fol) ، يتشكل لون بني أو أسود. ويفسر ذلك حقيقة أنه تحت تأثير القلويات ، ينشطر الكبريت من جذور السيستين في شكل أيون بحالة أكسدة ناقص اثنين ، والذي ، بالتفاعل مع أيون الرصاص (II) ، يعطي اللون البني أو راسب أسود غير قابل للذوبان من كبريتيد الرصاص. البروتينات التي لا تحتوي على السيستين والسيستين لا تعطي تفاعل Fohl. يمكن وصف كيمياء العملية بالتفاعلات التالية:
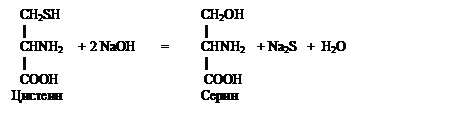 |
Na 2 S + Pb (CH 3 COO) 2 \ u003d PbS + 2CH 3 COONa
خلات الصوديوم خلات الرصاص
عند تسخينه بالقلويات ، يخضع جزء من البروتين للتحلل المائي. بالإضافة إلى ذلك ، يتم قطع جزء من المجموعات الأمينية (تفاعل نزع الأمين) على شكل أمونيا ، والتي يمكن اكتشافها عن طريق الرائحة وعن طريق ورق عباد الشمس الأحمر المبلل بالماء ، وإحضاره إلى فتحة أنبوب الاختبار (لا تلمس الجدران!).
تقدم. خذ أربعة أنابيب اختبار وأضف 1 مل لكل منها: في الأول من الماء ، في الثاني - محلول الكازين ، في الثالث - محلول بياض البيض ، في محلول الجيلاتين الرابع. يتم إضافة 1 مل من محلول به جزء كتلي من هيدروكسيد الصوديوم بنسبة 30٪ و6-8 قطرات من محلول مع جزء كتلي من أسيتات الرصاص بنسبة 5٪ إلى كل أنبوب ، أو يمكنك تحضير كاشف Fohl للمجموعة الفرعية بأكملها و أضف 1 مل لكل أنبوب من المحلول المحضر. يتم خلط المحتويات بالرج ، وتوضع الأنابيب في حمام مائي مغلي لمدة 5-7 دقائق. يتم تسجيل لون محتويات أنابيب الاختبار. النتائج معروضة في الجدول. واحد.
الكواشف: ماء مقطر (يشار إليه فيما بعد بالماء) ؛ حلول مع الكسور الجماعية: الكازين 1٪ ، الجيلاتين 1٪ ، بياض البيض 1٪ ، كبريتات النحاس 1٪ ، هيدروكسيد الصوديوم 10 و 30٪ ، الجلايسين (أو الأحماض الأمينية الأخرى) 0.1٪ ، الفينول 0.1٪ ، أسيتات الرصاص 5٪ ، النينهيدرين في الأسيتون أو الإيثانول 1٪ ؛ حمض النيتريك المركز.
يتم تحضير كاشف Fohl في أنبوب اختبار قبل التحديد. يُضاف 1 مل من محلول أسيتات الرصاص بنسبة 5٪ إلى أنبوب الاختبار ويُسكب محلول هيدروكسيد الصوديوم بنسبة 30٪ في أجزاء صغيرة (1.5-2 مل لكل منهما) بفاصل زمني قدره 30 ثانية ، في كل مرة ، مع التقليب ، حتى يصبح لونها أبيض حليبي الراسب الندري الذي يظهر بعد إضافة الجزء الأول يذيب هيدروكسيد الصوديوم.
أسئلة الاختبار:
1. الخصائص العامةالببتيدات ، عديد الببتيدات ، البروتينات وهياكلها.
2. كيف يتم ربط الأحماض الأمينية في جزيء البروتين وبأي مجموعات؟ قم بتوصيل Ala، Cys، Ser.
3. قائمة التفاعلات اللونية للبروتينات والأحماض الأمينية.
4. ما هو رد الفعل الذي يفتح روابط الببتيد؟ كيمياءها.
5. ما الذي يميز اللون وكثافة اللون مع تفاعل البيوريت الإيجابي؟
6. ماذا يكشف تفاعل النينهيدرين؟ كيمياءها.
7. قم بتسمية الأحماض الأمينية التي تحتوي على حلقة بنزين في الجذر. ما هو رد الفعل الذي يمكن أن يكشف عن الأحماض الأمينية العطرية؟ كيمياءها.
8. قم بتسمية الأحماض الأمينية التي تحتوي على الكبريت. أي منهم يكشفه رد فعل Fohl؟ كيمياء التفاعل.
9. ما هو رد الفعل اللوني المستخدم لقياس البروتينات في المحلول ولماذا؟
10. ما هو رد الفعل اللوني المستخدم لقياس الأحماض الأمينية ألفا ولماذا؟
تعريف
السناجبهي مركبات ذات وزن جزيئي مرتفع. يمكن أن تعزى بشكل مشروط إلى مجموعة البوليمرات.
الوحدات الأحادية للبروتينات هي الببتيدات ، والتي تتكون من الأحماض الأمينية. إذا كانت المادة تحتوي على أكثر من 100 بقايا من الأحماض الأمينية ، فإنها تُصنف على أنها بروتين ؛ ولا يزال أقل من 100 ببتيدًا. يمكن وصف تكوين البروتينات (رابطة الببتيد) بشكل تخطيطي على النحو التالي:
تحلل البروتين
البروتينات قادرة على التحلل المائي جزئيًا. إذا تخيلنا أن التحلل المائي يستمر حتى النهاية ، أي تمامًا ، ثم يتم الحصول على خليط من الأحماض الأمينية كمنتجات تفاعل. بالإضافة إلى هذه المواد ، تم العثور على الكربوهيدرات ، البيريميدين وقواعد البيورين في المحلول بعد التحلل المائي. صحيح حامض الفوسفوريك. يستمر التحلل المائي للبروتينات في ظل ظروف معينة: الغليان في محلول حمض أو قلوي.
إذا كانت البروتينات تحتوي على روابط أميدية بسبب وجود الأحماض الأمينية ذات الجذور الجانبية المتفرعة التي تخلق عوائق فلكية ، كما هو الحال في الليوسين أو الفالين ، فإن التحلل المائي مستحيل.
إذا تحطم البروتين إلى مكونات في وسط قلوي ، فسيتم إجراء التحلل المائي في وسط حمضي والعكس صحيح.
تقليديا ، يمكن كتابة معادلة تفاعل التحلل المائي للبروتين على النحو التالي:

لماذا يعتبر التحلل المائي للبروتين ضروريًا؟
نظرًا لأن البروتينات عبارة عن مركبات جزيئية كبيرة ، فقد لا يلاحظها الجسم بشكل سيئ ، نظرًا لأن أي منتج غذائي ، من أصل نباتي أو حيواني ، يحتوي على بروتينات. يكسر التحلل المائي البروتينات إلى منتجات ذات وزن جزيئي منخفض ، لذلك يتم استخدامه لتسريع هضم البروتينات ( غذاء رياضي)، تخفيض ردود الفعل التحسسية (طعام الأطفال، وخاصة تركيبات الحليب) ، للحصول على الأحماض الأمينية.
أمثلة على حل المشكلات
مثال 1
البروتينات-هذه هي جزيئات عالية (يتراوح الوزن الجزيئي من 5-10 آلاف إلى 1 مليون أو أكثر) بوليمرات طبيعية ، جزيئاتها مبنية من بقايا الأحماض الأمينية المتصلة بواسطة رابطة أميد (ببتيد).
تسمى البروتينات أيضًا بالبروتينات ("البروتوس" اليونانية - الأولى والمهمة). يختلف عدد بقايا الأحماض الأمينية في جزيء البروتين بشكل كبير ويصل أحيانًا إلى عدة آلاف. كل بروتين له تسلسله الخاص من بقايا الأحماض الأمينية.
تؤدي البروتينات مجموعة متنوعة من الوظائف البيولوجية: الحفازة (الإنزيمات) والتنظيمية (الهرمونات) والبنيوية (الكولاجين والفبروين) والمحرك (الميوسين) والنقل (الهيموغلوبين والميوغلوبين) والحماية (الغلوبولين المناعي والإنترفيرون) وقطع الغيار (الكازين والألبومين) جليادين) وغيرها.
البروتينات هي أساس الأغشية الحيوية ، وهي أهم جزء من مكونات الخلية والخلوية. يلعبون دورًا رئيسيًا في حياة الخلية ، ويشكلون ، كما كان ، الأساس المادي لنشاطها الكيميائي.
خاصية استثنائية للبروتين - هيكل التنظيم الذاتي، أي قدرتها على إنشاء بنية مكانية محددة بشكل عفوي خاصة ببروتين معين فقط. بشكل أساسي ، جميع أنشطة الكائن الحي (التطور ، الحركة ، الأداء بواسطته وظائف مختلفةوأكثر من ذلك بكثير) يرتبط بمواد بروتينية. من المستحيل تخيل الحياة بدون البروتينات.
البروتينات هي أهم عنصر في غذاء الإنسان والحيوان ، وهي مورد للأحماض الأمينية الأساسية.
هيكل البروتينات
في التركيب المكاني للبروتينات أهمية عظيمةله طابع الجذور (البقايا) R- في جزيئات الأحماض الأمينية. عادة ما توجد جذور الأحماض الأمينية غير القطبية داخل جزيء البروتين وتسبب تفاعلات كارهة للماء ؛ عادة ما توجد الجذور القطبية التي تحتوي على مجموعات أيونية (مكونة للأيونات) على سطح جزيء البروتين الكبير وتميز التفاعلات الكهروستاتيكية (الأيونية). يمكن أن توجد الجذور القطبية غير الأيونية (على سبيل المثال ، التي تحتوي على مجموعات OH الكحولية ، ومجموعات الأميد) على السطح وداخل جزيء البروتين. يشاركون في تكوين روابط هيدروجينية.
في جزيئات البروتين ، ترتبط الأحماض الأمينية ألفا ببعضها البعض بواسطة روابط الببتيد (-CO-NH-):
يمكن ربط سلاسل البولي ببتيد التي تم إنشاؤها بهذه الطريقة أو الأقسام المنفصلة داخل سلسلة البولي ببتيد في بعض الحالات بشكل إضافي ببعضها البعض عن طريق روابط ثاني كبريتيد (-S-S-) أو ، كما يطلق عليها غالبًا ، جسور ثاني كبريتيد.
تلعب الروابط الأيونية (الملح) والهيدروجين دورًا مهمًا في تكوين بنية البروتينات ، بالإضافة إلى التفاعل الكارهة للماء - وهو نوع خاص من الاتصال بين المكونات الكارهة للماء لجزيئات البروتين في البيئة المائية. كل هذه الروابط لها نقاط قوة مختلفة وتوفر تكوين جزيء بروتيني معقد وكبير.
على الرغم من الاختلاف في بنية ووظائف المواد البروتينية ، فإن تكوينها الأولي يختلف قليلاً (٪ من الوزن الجاف): الكربون - 51-53 ؛ الأكسجين - 21.5-23.5 ؛ النيتروجين - 16.8-18.4 ؛ الهيدروجين - 6.5-7.3 ؛ الكبريت - 0.3-2.5.
تحتوي بعض البروتينات على كميات صغيرة من الفوسفور والسيلينيوم وعناصر أخرى.
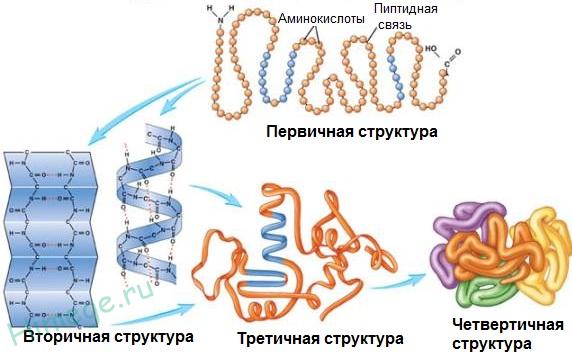
يسمى تسلسل بقايا الأحماض الأمينية في سلسلة بولي ببتيد التركيب الأساسي للبروتين.
قد يتكون جزيء البروتين من واحد أو أكثر من سلاسل بولي ببتيد ، كل منها يحتوي على عدد مختلف من بقايا الأحماض الأمينية. بالنظر إلى عدد التوليفات الممكنة ، يمكن القول أن تنوع البروتينات لا حدود له تقريبًا ، ولكن لا توجد جميعها في الطبيعة.
العدد الإجمالي للأنواع المختلفة من البروتينات في جميع أنواع الكائنات الحية هو 10 11-10 12. بالنسبة للبروتينات ، التي يكون هيكلها معقدًا للغاية ، بالإضافة إلى الهيكل الأساسي ، هناك أيضًا مستويات أعلى من التنظيم الهيكلي: الهياكل الثانوية والثالثية وأحيانًا الرباعية.
الهيكل الثانويلديها معظمالبروتينات ، ومع ذلك ، ليس دائمًا في جميع أنحاء سلسلة البولي ببتيد. يمكن ترتيب سلاسل البولي ببتيد مع بنية ثانوية معينة بشكل مختلف في الفضاء.
معلومة الهيكل الثالث، بالإضافة إلى الروابط الهيدروجينية ، تلعب التفاعلات الأيونية والطارئة للماء دورًا مهمًا. وفقًا لطبيعة "عبوة" جزيء البروتين ، كروي، أو كروي ، و ليفيأو البروتينات الخيطية (الجدول 12).
بالنسبة للبروتينات الكروية ، تكون البنية الحلزونية أكثر تميزًا ، وتكون الحلزونات منحنية و "مطوية". الجزيء له شكل كروي. تذوب في الماء و المحاليل الملحيةمع تكوين أنظمة غروانية. معظم البروتينات الحيوانية والنباتية والكائنات الحية الدقيقة عبارة عن بروتينات كروية.

بالنسبة للبروتينات الليفية ، يكون التركيب الخيطي أكثر تميزًا. بشكل عام لا تذوب في الماء. تؤدي البروتينات الليفية عادةً وظائف تكوين البنية. تعتمد خصائصها (القوة والقدرة على التمدد) على طريقة تعبئة سلاسل البولي ببتيد. مثال على البروتينات الليفية الميوسين ، الكيراتين. في بعض الحالات ، تشكل الوحدات الفرعية البروتينية الفردية مجموعات معقدة بمساعدة الروابط الهيدروجينية والتفاعلات الكهروستاتيكية والتفاعلات الأخرى. في هذه الحالة ، يتشكل هيكل رباعيالبروتينات.
الهيموغلوبين في الدم هو مثال على بروتين له هيكل رباعي. فقط مع مثل هذا الهيكل يؤدي وظائفه - ربط الأكسجين ونقله إلى الأنسجة والأعضاء.
ومع ذلك ، تجدر الإشارة إلى أن المنظمة الهياكل الشاهقةالبروتينات ، دور استثنائي ينتمي إلى الهيكل الأساسي.
تصنيف البروتين
هناك عدة تصنيفات للبروتينات:
- حسب درجة الصعوبة (بسيطة ومعقدة).
- حسب شكل الجزيئات (البروتينات الكروية والليفية).
- عن طريق الذوبان في المذيبات الفردية (قابل للذوبان في الماء ، قابل للذوبان في المحاليل الملحية المخففة - الألبومين ، القابل للذوبان في الكحول - البرولامين ، القابل للذوبان في القلويات والأحماض المخففة - الجلوتلينات).
- وفقًا للوظائف التي يتم إجراؤها (على سبيل المثال ، تخزين البروتينات والهيكل العظمي وما إلى ذلك).
خصائص البروتين
البروتينات هي إلكتروليتات مذبذبة. عند قيمة pH معينة للوسط (تسمى النقطة الكهربية) ، يكون عدد الشحنات الموجبة والسالبة في جزيء البروتين هو نفسه. هذه واحدة من الخصائص الرئيسية للبروتين. البروتينات في هذه المرحلة متعادلة كهربائيًا ، وقابليتها للذوبان في الماء هي الأدنى. تُستخدم قدرة البروتينات على تقليل قابلية الذوبان عندما تصبح جزيئاتها متعادلة كهربائيًا للعزل عن المحاليل ، على سبيل المثال ، في تقنية الحصول على منتجات البروتين.
ترطيب. تعني عملية الترطيب ارتباط الماء بالبروتينات ، بينما تظهر خصائص محبة للماء: فهي تنتفخ ، وتزداد كتلتها وحجمها. تورم البروتينات الفردية يعتمد فقط على بنيتها. تجذب مجموعات الأميد المحبة للماء (-CO-NH- ، رابطة الببتيد) ، والأمين (-NH 2) والكربوكسيل (-COOH) الموجودة في التركيبة والموجودة على سطح جزيء البروتين الكبير جزيئات الماء ، وتوجهها بدقة على السطح للجزيء. يمنع غلاف الماء (الماء) المحيط بكريات البروتين التجمع والترسيب ، وبالتالي يساهم في استقرار المحاليل البروتينية. عند النقطة الكهروضوئية ، يكون للبروتينات أقل قدرة على ربط الماء ، ويتم تدمير غلاف الترطيب حول جزيئات البروتين ، لذلك تتحد لتشكل مجاميع كبيرة. يحدث تجمع جزيئات البروتين أيضًا عند تجفيفها ببعض المذيبات العضوية ، على سبيل المثال ، الكحول الإيثيلي. هذا يؤدي إلى ترسيب البروتينات. عندما يتغير الرقم الهيدروجيني للوسط ، يصبح جزيء البروتين مشحونًا ، وتتغير قدرته على الترطيب.
مع انتفاخ محدود ، تشكل محاليل البروتين المركزة أنظمة معقدة تسمى هلام.
الهلام ليس سائلاً ، ومرنًا ، وله ليونة ، وقوة ميكانيكية معينة ، وهو قادر على الحفاظ على شكله. يمكن أن تكون البروتينات الكروية رطبة تمامًا ، وتذوب في الماء (على سبيل المثال ، بروتينات الحليب) ، وتشكل محاليل بتركيز منخفض. تعتبر الخصائص المحبة للماء للبروتينات ، أي قدرتها على الانتفاخ ، وتشكيل الهلام ، وتثبيت المعلقات ، والمستحلبات والرغوات ، ذات أهمية كبيرة في علم الأحياء و الصناعات الغذائية. الهلام المتنقل للغاية ، المصنوع أساسًا من جزيئات البروتين ، هو السيتوبلازم - الغلوتين الخام المعزول من عجين القمح ؛ يحتوي على 65٪ ماء. تعد قابلية الماء المختلفة لبروتينات الغلوتين إحدى السمات التي تميز جودة حبوب القمح والدقيق الذي يتم الحصول عليه منه (ما يسمى بالقمح القوي والضعيف). تلعب الألفة المائية للحبوب وبروتينات الدقيق دورًا مهمًا في تخزين الحبوب ومعالجتها ، في الخبز. العجين الذي يتم الحصول عليه في صناعة الخبز عبارة عن بروتين منتفخ في الماء ، وهو عبارة عن هلام مركز يحتوي على حبوب النشا.
تمسخ البروتين. أثناء التمسخ تحت التأثير عوامل خارجية(درجة الحرارة ، التأثير الميكانيكي ، عمل العوامل الكيميائية وعدد من العوامل الأخرى) هناك تغيير في الهياكل الثانوية والثالثية والرباعية للجزيء الضخم للبروتين ، أي هيكله المكاني الأصلي. الهيكل الأساسي ، وبالتالي التركيب الكيميائيالبروتينات لا تتغير. تتغير الخصائص الفيزيائية: تقل القابلية للذوبان ، والقدرة على الترطيب ، وفقدان النشاط البيولوجي. يتغير شكل جزيء البروتين ، يحدث التجميع. في الوقت نفسه ، يزداد نشاط بعض المجموعات الكيميائية ، ويتم تسهيل تأثير الإنزيمات المحللة للبروتينات ، وبالتالي ، يتم تحللها بسهولة أكبر.
في تقنية غذائيةأهمية عملية خاصة هو التمسخ الحراري للبروتينات ، والتي تعتمد درجتها على درجة الحرارة ومدة التسخين والرطوبة. يجب تذكر ذلك عند تطوير طرق المعالجة الحرارية للمواد الخام الغذائية ، والمنتجات شبه المصنعة ، وأحيانًا المنتجات النهائية. تلعب عمليات التمسخ الحراري دورًا خاصًا في تبييض مواد النبات وتجفيف الحبوب وخبز الخبز والحصول عليها معكرونة. يمكن أيضًا أن يحدث تمسخ البروتين بسبب العمل الميكانيكي (الضغط ، الاحتكاك ، الاهتزاز ، الموجات فوق الصوتية). أخيرًا ، يؤدي عمل الكواشف الكيميائية (الأحماض والقلويات والكحول والأسيتون) إلى تمسخ البروتينات. كل هذه التقنيات تستخدم على نطاق واسع في الغذاء والتكنولوجيا الحيوية.
الإرغاء. تُفهم عملية الرغوة على أنها قدرة البروتينات على تكوين أنظمة غاز سائل عالية التركيز ، تسمى الرغوات. إن استقرار الرغوة ، التي يكون فيها البروتين عامل نفخ ، لا يعتمد فقط على طبيعتها وتركيزها ، ولكن أيضًا على درجة الحرارة. تستخدم البروتينات كعوامل رغوية على نطاق واسع في صناعة الحلويات (أعشاب من الفصيلة الخبازية ، أعشاب من الفصيلة الخبازية ، سوفليه). تحتوي بنية الرغوة على خبز ، وهذا يؤثر على مذاقها.
يمكن تدمير جزيئات البروتين تحت تأثير عدد من العوامل أو التفاعل مع مواد أخرى لتشكيل منتجات جديدة. بالنسبة لصناعة الأغذية ، يمكن التمييز بين عمليتين مهمتين:
1) التحلل المائي للبروتينات تحت تأثير الإنزيمات ؛
2) تفاعل المجموعات الأمينية من البروتينات أو الأحماض الأمينية مع مجموعات الكاربونيل من السكريات المختزلة.
تحت تأثير إنزيمات البروتياز التي تحفز الانقسام المائي للبروتينات ، يتحلل الأخير إلى منتجات أبسط (متعدد الببتيدات وثنائي الببتيدات) وفي النهاية إلى أحماض أمينية. يعتمد معدل التحلل المائي للبروتين على تكوينه ، وبنيته الجزيئية ، ونشاط الإنزيم ، وظروفه.
تحلل البروتين.تفاعل التحلل المائي مع تكوين الأحماض الأمينية في نظرة عامةيمكن كتابتها على هذا النحو:

الإحتراق. تحترق البروتينات لتكوين النيتروجين ثاني أكسيد الكربونوالماء ، وكذلك بعض المواد الأخرى. يصاحب الحرق رائحة مميزة للريش المحترق.
تفاعلات اللون للبروتينات. من أجل التحديد النوعي للبروتين ، يتم استخدام التفاعلات التالية:
1) xantoprotein ،حيث يحدث تفاعل الدورات العطرية وغير المتجانسة في جزيء البروتين مع حمض النيتريك المركز ، مصحوبًا بظهور اللون الأصفر.
2) بيوريت، حيث تتفاعل المحاليل القلوية الضعيفة للبروتينات مع محلول كبريتات النحاس (II) مع تكوين مركبات معقدة بين أيونات النحاس 2+ وعديد الببتيدات. يكون رد الفعل مصحوبًا بظهور لون أزرق بنفسجي.
إرسال عملك الجيد في قاعدة المعرفة أمر بسيط. استخدم النموذج أدناه
سيكون الطلاب وطلاب الدراسات العليا والعلماء الشباب الذين يستخدمون قاعدة المعرفة في دراساتهم وعملهم ممتنين جدًا لك.
نشر على http://www.allbest.ru/
مؤسسة تعليم الموازنة الحكومية
التعليم المهني العالي
"جامعة سيبيريا الطبية الحكومية"
وزارة الصحة و التنمية الاجتماعيةالاتحاد الروسي
قسم الكيمياء
حول الموضوع: البروتينات
أنجزه: Temnova M.D.
تم الفحص: Prishchepova O.F.
تومسك ، 2015
2. تصنيف البروتينات
3. هيكل البروتينات
4. ردود الفعل النوعيةللسناجب
5. الخصائص الفيزيائية والكيميائية للبروتينات
6. مستحضرات البروتين والأحماض الأمينية وبدائل البروتين
فهرس
1. السناجب
البروتينات عبارة عن مواد عضوية جزيئية كبيرة تحتوي على النيتروجين مع تركيبة معقدة وبنية جزيئية.
الصيغة العامة:
يمكن اعتبار البروتين على أنه بوليمر معقد من الأحماض الأمينية.
تعد البروتينات جزءًا من جميع الكائنات الحية ، ولكنها تلعب دورًا مهمًا بشكل خاص في الكائنات الحية ، والتي تتكون من أشكال مختلفة من البروتينات (العضلات والأنسجة الغشائية ، اعضاء داخليةوالغضاريف والدم).
تقوم النباتات بتجميع البروتينات (ومكوناتها ، الأحماض الأمينية) من ثاني أكسيد الكربون CO 2 والماء H 2 O من خلال التمثيل الضوئي ، واستيعاب العناصر المتبقية من البروتينات (النيتروجين N ، الفوسفور P ، الكبريت S ، الحديد Fe ، المغنيسيوم Mg) من الأملاح القابلة للذوبان الموجودة في التربة.
تتلقى الكائنات الحية بشكل أساسي الأحماض الأمينية الجاهزة مع الطعام وتبني بروتينات أجسامها على أساسها. يمكن تصنيع عدد من الأحماض الأمينية (الأحماض الأمينية غير الأساسية) مباشرة بواسطة الكائنات الحية.
السمة المميزة للبروتينات هي تنوعها المرتبط بعدد وخصائص وطرق اتصال الأحماض الأمينية الموجودة في جزيءها. تؤدي البروتينات وظيفة المحفزات الحيوية - وهي إنزيمات تنظم سرعة واتجاه التفاعلات الكيميائية في الجسم. بالاقتران مع الأحماض النووية ، فإنها توفر وظائف النمو ونقل الصفات الوراثية ، وهي الأساس الهيكلي للعضلات وتؤدي إلى تقلص العضلات.
تحتوي جزيئات البروتين على روابط متكررة من C (0) - NH amide ، تسمى روابط الببتيد (نظرية عالم الكيمياء الحيوية الروسي A.Ya. Danilevsky).
وبالتالي ، فإن البروتين هو عديد ببتيد يحتوي على مئات أو آلاف وحدات الأحماض الأمينية.
ترطيب البروتين الكيميائي الأحماض الأمينية
2. تصنيف البروتين
يعتبر تصنيف البروتينات مشروطًا إلى حد كبير ويستند إلى ميزات مختلفة ، وغالبًا ما تكون عشوائية. تنقسم البروتينات إلى أنسجة حيوانية ، ونباتية ، وبكتيرية ، وأنسجة ليفية وكروية ، وعضلية ، وأنسجة عصبية ، وما إلى ذلك. نظرًا للتنوع الاستثنائي للبروتينات ، لا يمكن اعتبار أي تصنيف مرضيًا ، نظرًا لأن العديد من البروتينات الفردية لا تتناسب مع أي مجموعة. تنقسم ب.
· بروتينات بسيطة(بروتينات).
1) الألبومينات هي بروتينات كروية. قابل للذوبان في ماء نظيفوالمحاليل المالحة. تترسب عندما يكون المحلول مشبعًا بكبريتات الأمونيوم. الممثلون النموذجيون: ألبومين البيض ، ألبومين المصل.
2) الجلوبيولين عبارة عن بروتينات كروية ، ولكنها ذات وزن جزيئي أعلى. قابل للذوبان في المحاليل الملحية المخففة ، غير قابل للذوبان في الماء النقي. ترسب في محلول شبه مشبع من كبريتات الأمونيوم. تشمل هذه المجموعة الجلوبيولين في مصل الدم والحليب والقنب وعدد من البروتينات الحيوانية والنباتية الأخرى.
3) البرولامين (الجليادين) - بروتينات بذور الحبوب. قابل للذوبان في 70-80٪ كحول وغير قابل للذوبان في الماء. غنية نسبيًا بالبرولين و حمض الجلوتاميك. الممثلين النموذجيين: القمح جليادين ، الشعير ، الذرة زين.
4) الجلوتلين - بروتينات الحبوب. قابل للذوبان في الأحماض أو القلويات المخففة ، ولكن ليس في المحاليل المحايدة.
5) البروتينات الصلبة (الزلال ، البروتينات) - غير قابلة للذوبان في الماء ، المحاليل الملحية ، الأحماض والقلويات المخففة ، بشكل رئيسي من أصل حيواني ، وتحمل وظائف هيكلية (داعمة في كثير من الأحيان). عادةً ما تكون البروتينات الصلبة عبارة عن بروتينات ليفية شديدة المقاومة لعمل الإنزيمات الهاضمة. وتشمل هذه البروتينات الليفية النسيج الضام, الكولاجينتوجد في العظام والجلد والأوتار. يتميز الكولاجين بتكوين الجيلاتين عند تسخينه بالماء ، والذي يتحول إلى مادة هلامية عند تبريده ، ويذوب عند تسخينه. يحتوي الكولاجين على الكثير من البرولين وخاصة الهيدروكسي برولين. مجموعة أخرى من بروتينات النسيج الضام هي الإيلاستين. تشمل البروتينات المصلبة أيضًا كيراتين الشعر ، والصوف ، والغنية بالسيستين ، والألياف الليفية من الحرير ، وخيوط العنكبوت ، وما إلى ذلك.
6) Protamines - بروتينات ذات طابع رئيسي ، موجودة في الحيوانات المنوية لبعض الأسماك والحيوانات الأخرى في شكل معقدات مع DNA. لها وزن جزيئي صغير نسبيًا ، وتحتوي على الكثير من الأرجينين وبعض الأحماض أحادية أمينومونوكربوكسيليك. في بعض الأحيان تشمل ليسين وهستيدين. الأكثر دراسة هي اللوبين (بروتامين من حيوانات منوية الرنجة) ، السلمون (من حيوانات منوية السلمون).
7) الهيستونات - بروتينات ذات طابع أساسي أقل وضوحًا وغنية بأحماض ديامينومونوكربوكسيل. هم جزء من البروتينات النووية لنواة الخلية.
· بروتينات معقدة(بروتينات).
· البروتينات النووية - مجمعات البروتين مع الأحماض النووية. لديهم وزن جزيئي مرتفع للغاية. يلعب الدور الأساسيفي التخليق الحيوي للبروتين في الجسم ، وفي نقل الصفات الوراثية ، وما إلى ذلك.
1) البروتينات المخاطية - بروتينات تحتوي على عديدات السكاريد المخاطية - مجموعات كربوهيدرات حمضية (مخاطية ، مخاطية). يحتوي بشكل رئيسي على المخاط واللعاب والسائل الزليلي ، إلخ.
2) تحتوي البروتينات الفوسفورية على حمض الفوسفوريك ، وعادة ما يكون على شكل إستر مع مجموعة هيدروكسي سيرين. الممثلين الرئيسيين: كازين الحليب ، محي صفار البيض.
3) البروتينات المعدنية - معقدات من البروتينات تحتوي على معادن أو مجموعات عضوية تحتوي على ذرات معدنية. وتشمل هذه العديد من البروتينات (البروتينات التي تحتوي على مجموعات ملونة) ، مثل الهيموجلوبين وأصباغ الدم الأخرى ، والعديد من الإنزيمات ، مثل الأكسيدازات التي تحتوي على الحديد أو النحاس ، إلخ.
4) البروتينات الدهنية - مجمعات البروتينات ذات الدهون المختلفة. في الدم يلعبون دورًا مهمًا في نقل الدهون. هم جزء من أغشية الخلايا والأغشية الداخلية لهياكل الخلايا.
يوجد أيضًا تصنيف للبروتينات اعتمادًا على الوظائف التي يؤديها الفصل:
|
المحفز. أكثر مجموعات البروتينات عددًا هي بروتينات-إنزيمات تحفز الحيوية تفاعلات كيميائية. بمساعدة بروتينات الإنزيم في الخلية الحية ، يتم تحقيق تسلسل منتظم التحولات الكيميائيةالمواد التي تحافظ على الكائنات الحية على قيد الحياة. |
أوكسيدوروكتازات ، ترانسالات ، هيدروليسات ، لياز ، إيزوميراز ، ليجاسيس (مواد تركيبية) |
|
|
المواصلات. أنها تحمل جزيئات أو أيونات معينة. |
الهيموغلوبين (يربط الأكسجين وينقله إلى الأنسجة المحيطية) ، الهيموسيانين ، الألبومين ، الميوغلوبين |
|
|
الهيكلي. هم جزء من أنسجة نباتية. كما أنها تشكل الأساس الهيكلي للأغشية الحيوية للخلية ، مما يضمن أن عضيات الخلية تحافظ على التسلسل الضروري للتفاعلات الكيميائية الحيوية. |
الكولاجين والكيراتين والإيلاستين هيستونز ، فيبروين |
|
|
تنظيمية. تشارك هذه البروتينات في تنظيم التفاعلات الأيضية. |
Somatotropin ، الأنسولين ، الجلوكاجون ، التروبوميوسين ، الثيروتروبين ، الجونادوتروبين ، هرمون الغدة الجار درقية |
|
|
محمي. تحمي البروتينات الواقية الكائن الحي من التلف أو تساهم في بقائه في حالة حدوث ضرر. تتمثل الوظيفة الوقائية للبروتينات - السموم التي تنتجها النباتات - في أنها تحمي النباتات من أن تأكلها الحيوانات ، كما أنها تمنع الإنزيمات المحللة للبروتين في الآفات الحشرية التي تتلف بذور العديد من النباتات. |
الغلوبولين المناعي ، الإنترفيرون ، الفيبرينوجين ، الفيبرين ، البروثرومبين ، الثرومبين |
|
|
إضافي. احتياطي البروتينات في كميات كبيرةتتراكم في خلايا الحبوب والبذور أثناء النضج على النبات ، وبعد ذلك ، أثناء الإنبات ، يتم تحللها إلى أحماض أمينية أو ببتيدات جزيئية ، والتي تستخدمها الخلية بعد ذلك لتشكيل نبات جديد المراحل الأولىتطوير. في جسم الحيوان ، لا يتم تخزين البروتينات في المحمية ، لذلك يجب تزويدها بالطعام يوميًا بالكميات المطلوبة. |
في الحيوانات - الفيريتين ، الألبومين ، الكازين في النباتات - الليجومين والفيكيلين (بذور البازلاء) ، والغلوتين ، والبرولين ، والسيرين (بذور القمح) ، والأوريزينين (بذور الأرز) |
|
|
منقبض. تشارك العديد من المواد البروتينية في تقلص العضلات واسترخائها. لكن دور قيادييلعب الأكتين والميوسين ، بروتينات معينة ، في هذه العمليات الحيوية أنسجة عضلية. الوظيفة الانقباضية ليست فقط في بروتينات العضلات ، ولكن أيضًا في بروتينات الهيكل الخلوي ، التي توفر أجود العملياتنشاط الخلية الحيوي (الفصل الكروموسوم أثناء الانقسام). |
الميوسين ، الأكتين ، التوبولين |
3. هيكل البروتينات
بين المواد العضوية السناجب، أو البروتينات، - البوليمرات الحيوية الأكثر عددًا والأكثر تنوعًا والأكثر أهمية. فهم يمثلون 50 -- 80% الوزن الجاف للخلية.
جزيئات البروتين لها أحجام كبيرة، لذلك تم استدعاؤهم الجزيئات الكبيرة. بالإضافة إلى الكربون والأكسجين والهيدروجين والنيتروجين ، يمكن أن تحتوي البروتينات على الكبريت والفوسفور والحديد. تختلف البروتينات عن بعضها البعض في العدد (من مائة إلى عدة آلاف) ، وتكوين وتسلسل المونومرات. مونومرات البروتين هي أحماض أمينية.
يتم إنشاء مجموعة متنوعة لا حصر لها من البروتينات من خلال مجموعات مختلفة من كل شيء 20 أحماض أمينية. كل حمض أميني له اسمه الخاص وبنيته الخاصة وخصائصه. هم الصيغة العامةيمكن تقديمها بالشكل التالي:
يتكون جزيء الأحماض الأمينية من جزأين متطابقين لجميع الأحماض الأمينية ، أحدهما عبارة عن مجموعة أمينية (- نيو هامبشاير 2 ) مع الخصائص الأساسية ، والآخر - مجموعة الكربوكسيل (- COOH) ذات الخصائص الحمضية. يسمى الجزء من الجزيء الراديكالي ( ر) ، الأحماض الأمينية المختلفة لها هياكل مختلفة. يحدد وجود المجموعات الأساسية والحمضية في جزيء حمض أميني واحد تفاعلها العالي. من خلال هذه المجموعات ، ترتبط الأحماض الأمينية لتشكيل بروتين. في هذه الحالة ، يظهر جزيء الماء ، وتشكل الإلكترونات المحررة رابطة ببتيدية. هذا هو سبب تسمية البروتينات بولي ببتيدات.
يمكن أن تحتوي جزيئات البروتين على تكوينات مكانية مختلفة ، وتتميز أربعة مستويات من التنظيم الهيكلي في هيكلها.
1. الهيكل الأساسي.
تسلسل الأحماض الأمينية في سلسلة البولي ببتيد هو الهيكل الأساسيسنجاب. إنه الهيكل الأساسي لجزيء البروتين الذي يحدد خصائص جزيئات البروتين وتكوينه المكاني. يؤدي استبدال حمض أميني واحد فقط بآخر في سلسلة البولي ببتيد إلى تغيير خصائص ووظائف البروتين. على سبيل المثال ، يؤدي استبدال الحمض الأميني الجلوتامين السادس في الوحدة الفرعية β للهيموجلوبين بالفالين إلى حقيقة أن جزيء الهيموجلوبين ككل لا يمكنه أداء وظيفته الرئيسية - نقل الأكسجين ؛ في مثل هذه الحالات ، يصاب الشخص بمرض - فقر الدم المنجلي.
طرق دراسة التركيب الأساسي للبروتين.
تعتبر دراسة التركيب الأساسي للبروتينات ذات أهمية بيولوجية وطبية عامة كبيرة. من خلال دراسة ترتيب تناوب بقايا الأحماض الأمينية في البروتينات الفردية ومقارنة هذه المعرفة بخصائص الترتيب المكاني للجزيء ، من الممكن الكشف عن الأنماط الأساسية العامة لتشكيل البنية المكانية للبروتينات.
بالإضافة إلى ذلك ، كثير أمراض وراثية- نتيجة انتهاك تسلسل الأحماض الأمينية للبروتينات. يمكن أن تكون المعلومات حول التركيب الأساسي للبروتينات الطبيعية والمتحولة مفيدة في التشخيص والتنبؤ بتطور المرض.
يتضمن إنشاء الهيكل الأساسي للبروتينات مرحلتين رئيسيتين:
* تحديد تركيبة الأحماض الأمينية للبروتين المدروس.
* تحديد تسلسل الأحماض الأمينية في البروتين.
2. الهيكل الثانوي.
معظم البروتينات لها شكل حلزوني نتيجة لتكوين روابط هيدروجينية بين - CO-و -- NH-مجموعات من بقايا الأحماض الأمينية المختلفة من سلسلة البولي ببتيد. الروابط الهيدروجينية ضعيفة ، ولكنها مجتمعة توفر بنية قوية إلى حد ما. هذا هو دوامة الهيكل الثانويسنجاب. في هذه الحالة ، يمكن أن تكتسب سلاسل الببتيد هياكل منتظمة من نوعين: β-helix و-structure.
ب- حلزوني
في هذا النوع من البنية ، يلتف العمود الفقري للببتيد على شكل حلزوني بسبب تكوين روابط هيدروجينية بين ذرات الأكسجين لمجموعات الكاربونيل وذرات النيتروجين في المجموعات الأمينية التي تشكل مجموعات الببتيد من خلال 4 بقايا من الأحماض الأمينية . الروابط الهيدروجينية موجهة على طول محور اللولب. هناك 3.6 بقايا من الأحماض الأمينية في كل دورة من الحلزون ب.
تشارك جميع ذرات الأكسجين والهيدروجين تقريبًا في مجموعات الببتيد في تكوين روابط هيدروجينية. نتيجة لذلك ، يتم "التعاقد" على اللولب b بواسطة العديد من الروابط الهيدروجينية. على الرغم من حقيقة أن هذه الروابط مصنفة على أنها ضعيفة ، فإن عددها يضمن أقصى قدر ممكن من الاستقرار للحلزون b. نظرًا لأن جميع المجموعات المحبة للماء في العمود الفقري للببتيد تشارك عادةً في تكوين الروابط الهيدروجينية ، فإن المحبة للماء (أي القدرة على تكوين روابط هيدروجينية مع الماء) من b-helices تتناقص ، وتزداد كرهها للماء. ب- هيكل حلزوني - الشكل الأكثر استقرارًا للعمود الفقري الببتيد ، والذي يتوافق مع الحد الأدنى من الطاقة الحرة. نتيجة لتشكيل الحلزونات b ، يتم تقصير سلسلة البولي ببتيد ، ولكن إذا تم إنشاء ظروف لكسر روابط الهيدروجين ، فإن سلسلة البولي ببتيد ستطول مرة أخرى.
في-بنيةتتشكل بسبب تكوين العديد من الروابط الهيدروجينية بين ذرات مجموعات الببتيد للمناطق الخطية لسلسلة واحدة من البولي ببتيد مما يجعل الانحناءات ، أو بين سلاسل مختلفة من عديد الببتيد. تشكل بنية β شكلًا مشابهًا لصفيحة مطوية في "أكورديون" - طبقة مطوية.
عندما تتشكل روابط الهيدروجين بين ذرات العمود الفقري للببتيد من سلاسل متعددة الببتيد المختلفة ، فإنها تسمى روابط interstrand. تسمى الروابط الهيدروجينية التي تحدث بين المناطق الخطية داخل نفس سلسلة عديد الببتيد intrachain. في الهياكل β ، توجد روابط الهيدروجين عموديًا على سلسلة البولي ببتيد.
إذا تم توجيه سلاسل البولي ببتيد المقيدة بشكل معاكس ، تنشأ بنية متوازنة ، ولكن إذا تزامنت طرفي N- و C من سلاسل polypeptide ، يتم تشكيل بنية طبقة متوازية.
3. الهيكل الثالث.
الهيكل الثالث- "تعبئة" مكانية ثلاثية الأبعاد لسلسلة البولي ببتيد. والنتيجة هي تكوين غريب ، لكن محدد لكل بروتين - كرية دم. يتم توفير قوة البنية الثلاثية من خلال روابط مختلفة تنشأ بين جذور الأحماض الأمينية.
4. هيكل رباعيليس نموذجيًا لجميع البروتينات. ينشأ نتيجة الجمع بين العديد من الجزيئات الكبيرة مع بنية من الدرجة الثالثة في مجمع معقد. على سبيل المثال ، الهيموجلوبين في الدم البشري هو مركب من أربعة جزيئات بروتينية كبيرة.
يرتبط هذا التعقيد في بنية جزيئات البروتين بمجموعة متنوعة من الوظائف المتأصلة في هذه البوليمرات الحيوية.
يسمى انتهاك التركيب الطبيعي للبروتين تمسخ. يمكن أن يحدث تحت تأثير درجة الحرارة ، مواد كيميائيةوالطاقة المشعة وعوامل أخرى. مع تأثير ضعيف ، ينهار الهيكل الرباعي فقط ، مع هيكل أقوى ، الثالث ، ثم الثانوي ، ويبقى البروتين في شكل سلسلة بولي ببتيد.
هذه العملية قابلة للعكس جزئيًا: إذا لم يتم إزعاج الهيكل الأساسي ، فإن البروتين المحوَّل الصفات يكون قادرًا على استعادة هيكله. ويترتب على ذلك أن جميع ميزات بنية جزيء البروتين يتم تحديدها من خلال هيكلها الأساسي.
4. ردود الفعل النوعية على البروتينات
· تفاعل بيوتروفسكي (تفاعل بيوريت)
في البروتينات ، ترتبط الأحماض الأمينية ببعضها البعض عن طريق نوع polypeptides و diketopiperazines. يحدث تكوين عديد الببتيدات من الأحماض الأمينية عن طريق فصل جزيء الماء عن المجموعة الأمينية لجزيء الأحماض الأمينية ومجموعة الكربوكسيل لجزيء آخر:
تسمى المجموعة -C (O) -NH- الناتجة مجموعة الببتيد ، وتسمى رابطة C-N التي تربط بقايا جزيئات الأحماض الأمينية رابطة الببتيد. عندما يتفاعل ثنائي الببتيد مع جزيء جديد من الأحماض الأمينية ، يتم الحصول على ثلاثي الببتيد ، وما إلى ذلك. يتم تشكيل Diketopiperazines عن طريق تفاعل جزيئين من الأحماض الأمينية مع إزالة جزيئين من الماء:
تم عزل Diketopiperazines من البروتينات بواسطة N.D. Zelinsky و VS Sadikov في عام 1923.
يتم تأكيد وجود مجموعات الببتيد المتكررة في البروتين من خلال حقيقة أن البروتينات تعطي لونًا بنفسجيًا عند تعرضها لكمية صغيرة من المحلول. الزاج الأزرقفي وجود القلويات (تفاعل بيوريت).
· تفاعل XANTOPROTEIN
يستخدم هذا التفاعل للكشف عن الأحماض الأمينية التي تحتوي على جذور عطرية. التيروزين ، التربتوفان ، فينيل ألانين ، عند التفاعل مع حمض النيتريك المركز ، تشكل مشتقات النيترو ذات اللون الأصفر. في البيئة القلوية ، تعطي مشتقات النيترو لهذه الأحماض الأمينية أملاحًا برتقالية اللون:
· رد فعل كامل
هذا هو رد فعل للسيستين والسيستين. أثناء التحلل المائي القلوي ، ينفصل "الكبريت ضعيف الارتباط" في السيستين والسيستين بسهولة ، مما يؤدي إلى تكوين كبريتيد الهيدروجين ، والذي يتفاعل مع القلويات ، ويعطي كبريتيد الصوديوم والبوتاسيوم. عند إضافة أسيتات الرصاص (II) ، يتشكل راسب أسود رمادي من كبريتيد الرصاص (II):
· اختبار NINGIDRIN (تفاعل Ruemann)
تتفاعل الأحماض الأمينية مع النينهيدرين لتكوين مركب أزرق بنفسجي (أرجواني Ruemann) ، كثافة لونه تتناسب مع كمية الأحماض الأمينية:
· رد فعل ساكاغوتشي
يعتمد رد الفعل هذا على حمض الأرجينين الأميني على تفاعل الأرجينين مع النافثول في وجود عامل مؤكسد. لم يتم توضيح آليتها بشكل كامل. على ما يبدو ، يتم إجراء التفاعل وفقًا للمعادلة التالية:
· رد فعل ميلون
رد الفعل هذا للحمض الأميني التيروزين. كاشف ميلون (محلول HgNO 3 و Hg (NO 2) 2 في HNO 3 المخفف الذي يحتوي على شوائب من HNO 2) يتفاعل مع التيروزين لتكوين ملح زئبقي من مشتق نيترو من التيروزين ، بلون أحمر وردي:
أملاح الزئبق لمشتق نيترو من التيروزين ( اللون الوردي)
· رد فعل آدمكيفيتش
التفاعل النوعي اللوني للبروتينات المحتوية على التربتوفان والتريبتوفان ، بناءً على اللون البنفسجي والأزرق لمحاليلها بعد إضافة حمض الجليوكسيليك وأحماض الكبريتيك المركزة.
· مراجعة إيرليك
تفاعل 4-dimethylaminobenzaldehyde (ما يسمى كاشف Ehrlich) مع التربتوفان أو مخلفاته في البروتينات (الببتيدات) وفقًا للمخطط:
5. الخصائص الفيزيائية والكيميائية للبروتينات
يحدد تكوين الأحماض الأمينية والتنظيم المكاني لكل بروتين خصائصه الفيزيائية والكيميائية. البروتينات لها خصائص حمضية قاعدية وعازلة وغروانية وتناضحية.
الخصائص الغروية والتناضحية للبروتينات
سلوك البروتينات في المحاليل له بعض الخصائص المميزة. تكون المحاليل الغروية العادية مستقرة فقط في حالة وجود عامل استقرار يمنع ترسيب الغرويات الموجودة في واجهة المذيب المذاب.
المحاليل المائية للبروتينات مستقرة ومتوازنة ؛ فهي لا تترسب (لا تتخثر) بمرور الوقت ولا تتطلب وجود مثبتات. حلول البروتين متجانسة ويمكن تصنيفها في جوهرها على أنها حلول حقيقية. ومع ذلك ، فإن الوزن الجزيئي العالي للبروتينات يعطي حلولها العديد من خصائص الأنظمة الغروانية:
الخصائص البصرية المميزة (بريق المحاليل وقدرتها على تشتيت الأشعة ضوء مرئي)
معدل انتشار منخفض
عدم القدرة على اختراق الأغشية شبه النفاذة
· اللزوجة العاليةحلول
القدرة على تكوين المواد الهلامية
ترطيب البروتينات والعوامل التي تؤثر على قابليتها للذوبان
البروتينات - المواد المحبة للماء. إذا قمت بإذابة بروتين جاف في الماء ، فإنه في البداية ، مثل أي مركب جزيئي عالي المحبة للماء ، يتضخم ، ثم تبدأ جزيئات البروتين بالمرور تدريجيًا إلى المحلول. أثناء الانتفاخ ، تخترق جزيئات الماء البروتين وترتبط بمجموعاته القطبية. يتم فك التعبئة الكثيفة لسلاسل البولي ببتيد. يمكن اعتبار البروتين المتورم كحل خلفي ، أي محلول من جزيئات الماء في مادة جزيئية عالية - البروتين. يؤدي الامتصاص الإضافي للماء إلى فصل جزيئات البروتين عن الكتلة الكلية والانحلال. لكن التورم لا يؤدي دائمًا إلى الانحلال ؛ تظل بعض البروتينات ، مثل الكولاجين ، منتفخة بعد امتصاص كميات كبيرة من الماء.
يرتبط الذوبان بترطيب البروتينات ، أي ارتباط جزيئات الماء بالبروتينات. يرتبط الماء الرطب بقوة بجزيء البروتين الضخم بحيث يصعب فصله. لا يشير هذا إلى امتصاص بسيط ، ولكن يشير إلى الارتباط الكهروستاتيكي لجزيئات الماء مع مجموعات قطبية من الجذور الجانبية للأحماض الأمينية الحمضية التي تحمل شحنة سالبة والأحماض الأمينية الأساسية التي تحمل شحنة موجبة.
العوامل المؤثرة على ذوبان البروتينات. تختلف قابلية ذوبان البروتينات المختلفة بشكل كبير. يتم تحديده من خلال تكوين الأحماض الأمينية (تعطي الأحماض الأمينية القطبية قابلية ذوبان أكبر من تلك غير القطبية) ، وخصائص التنظيم (البروتينات الكروية عادة ما تكون قابلة للذوبان بشكل أفضل من البروتينات الليفية) ، وخصائص المذيبات. فمثلا، بروتينات نباتية- البرولامين - يذوب في 60-80٪ كحول ، الألبومين - في الماء وفي المحاليل الملحية الضعيفة ، والكولاجين والكيراتين غير قابل للذوبان في معظم المذيبات.
التمسخ (التمسخ) وإعادة التشبع (إعادة التنشيط)
قيد العمل مواد مختلفةينتهك مستويات أعلىتنظيم جزيء البروتين (ثانوي ، ثالث ، رباعي) مع الحفاظ على الهيكل الأساسي ، يفقد البروتين الفيزيائي الكيميائي الأصلي ، والأهم من ذلك ، الخصائص البيولوجية. هذه الظاهرة تسمى تمسخ (تمسخ). إنها مميزة فقط للجزيئات التي لها تنظيم مكاني معقد. الببتيدات الاصطناعية والطبيعية ليست قادرة على التمسخ.
أثناء التمسخ ، يتم كسر الروابط التي تثبت الهياكل الرباعية والثالثية وحتى الثانوية. تتكشف سلسلة البولي ببتيد وتكون في محلول إما في شكل غير مطوي أو في شكل ملف عشوائي. في هذه الحالة ، تفقد قشرة الماء وترسب البروتين. ومع ذلك ، يختلف البروتين المحوَّل الخواص المترسب عن نفس البروتين المترسب عن طريق التمليح ، لأنه يفقد في الحالة الأولى. الخصائص الأصلية، ويحفظ في الثانية. يشير هذا إلى أن آلية عمل المواد التي تسبب تمسخًا وتمليحًا مختلفة. أثناء التمليح ، يتم الحفاظ على التركيب الأصلي للبروتين ، وأثناء تمسخه ، يتم تدميره.
تنقسم عوامل التحوير إلى:
بدني؛
· المواد الكيميائية؛
6. يكونالمخدرات وأحماض مينو وحبدائل البروتين
الجلوبيولين غير محدد (طبيعي). المحلول المائيجزء الجلوبيولين من بروتين مصل الدم الحيواني. حل واضح. يحتوي على جاما وبيتا جلوبيولين.
له تأثير محفز ، ويسرع نمو وتطور الحيوانات.
يستخدم لتسريع نمو الحيوانات الصغيرة ومنعها أمراض الجهاز الهضمي. لعلاج أمراض الرئة والجهاز الهضمي ، من الأفضل استخدامها مع عوامل العلاج الكيميائي. يوصف الدواء تحت الجلد أو العضل من الأيام الأولى من الحياة.
الغلوبولين المناعي الطبيعي. التحضير المركب لمصل الدم غاما الجلوبيولين (الخنازير) وكبريتات الصوديوم. حل براق قليلا.
يعمل ويستخدم مثل الجلوبيولين غير النوعي.
يوصف للوقاية والعلاج من أمراض الجهاز الهضمي بالتزامن مع المضادات الحيوية والسلفوناميدات ، لزيادة المقاومة وتسريع نمو الحيوانات حديثي الولادة.
ميثيونين.مسحوق بلوري أبيض ، قابل للذوبان في الماء. تلقي صناعيا. الميثيونين هو حمض أميني أساسي موجود باستمرار في الجسم.
عمل. يشارك في التمثيل الغذائي ، في تحييد السموم ومنتجات التمثيل الغذائي في الجسم ، في تخليق العديد من الهرمونات والوسطاء والفيتامينات.
يتم استخدامه لتسريع نمو وتسمين الخنازير والطيور ، لزيادة إنتاج بيض الطيور. عدد كبير منيحتوي الميثيونين على الجبن القريش ، والذي يستخدمه الدجاج أيضًا لتسريع نموه.
لتسريع عمليات الاسترداد ، يوصى بإدراج مستحضرات غذائية خاصة في القائمة. وتشمل هذه: خليط غذائي "ارغوتون" ، "ريجوزال" ، "ريبيرول" ، "دينفيتول" ، عصائر التساميوغيرها من المنتجات التي تحتوي على مركب متوازن من البروتينات والدهون والكربوهيدرات والفيتامينات والعناصر النزرة.
استنتاج
يلعب البروتين دورًا حيويًا في أجسامنا.
إنه يشكل ويشكل أنسجة أعضائنا وعضلاتنا. إنه ضروري لتخليق الهرمونات. تتكون الإنزيمات من البروتين الذي بدونه خلايا الجسم - خان. لا يمكن للجهاز العصبي أيضًا أن يعمل بدون بروتين ، منذ انتقال المعلومات الخلوية على طول الجهاز العصبيسوف ينكسر. سوف نتحرك ببطء وبشكل غير صحيح ونفكر بغباء. الجهاز المناعيسوف تضعف ، وأقل نسيم سيكون كافيا لنا للإصابة بمرض تنفسي حاد. بدون البروتينات ، لن يتخثر دمك ، وإذا جرحت نفسك أثناء الحلاقة أو مسكت السكين بلا مبالاة ، فإنك تخاطر بالنزيف بدون أثر.
يعمل البروتين على تطبيع وظائف الكبد والكلى ويؤثر على صحة بشرتنا. إذا قللنا من تناولنا للبروتين إلى حد كبير ، فسوف نتقدم في العمر بسرعة كارثية. يشارك البروتين في عمليات الطاقة في الجسم وينتج 4 سعرات حرارية من الطاقة من 1 جرام.
وبصفة عامة ، الحمض النووي الخاص بنا هو جزيء بروتيني ، وهو مادة بناء الكائن الحي بأكمله. كل هذا يعني أن البروتينات ، بطريقة أو بأخرى ، تشارك في معظم العمليات التي تحدث في أجسامنا ، ولا يمكننا الاستغناء عنها. البروتينات ليست دهون ، فهي لا تتراكم. لذلك ، يجب أن يدخلوا أجسادنا باستمرار وبشكل منتظم. وبطبيعة الحال ، مع الأطعمة التي تحتوي على البروتين.
أين يوجد البروتين؟
في الحليب والسمك. وهو يهضم بشكل أسرع. يتم هضم البروتين في اللحوم بشكل أبطأ إلى حد ما. ويتم هضم البروتينات ببطء شديد أصل نباتي. لذلك ، من أجل الحفاظ على وظائف الجسم بالترتيب ، يجب أن يكون الجزء الأكبر من البروتينات من أصل حيواني. يجب أن تكون النسب - حسب العلم - على النحو التالي: 70٪ من البروتينات التي تدخل الجسم يجب أن تكون من أصل حيواني (اللحوم والحليب والبيض والأسماك على سبيل المثال) و 30٪ - الخضار (الخبز والبازلاء والبطاطس). علاوة على ذلك ، فإن البروتينات من أصل حيواني لها مجموعة كاملة للغاية من البروتينات التي يحتاجها الجسمالأحماض الأمينية ، والتي لا يمكن أن يقال عن البروتين من أصل نباتي. يحتوي البروتين الكامل من أصل نباتي على حبوب فقط. لذلك ، عند اتباع نظام غذائي أو رفض اللحوم (والأسماك) ، فإننا ببساطة ندمر أجسادنا ، مما يؤدي إلى اختلال التوازن ، ونتيجة لذلك ، إلى الموت.
فهرس
1) المورد الإلكتروني:
2) المورد الإلكتروني:
3) المورد الإلكتروني:
4) المورد الإلكتروني:
5) المورد الإلكتروني:
6) المورد الإلكتروني:
7) الكيمياء الحيوية: كتاب مدرسي للجامعات / محرر. ES Severina - الطبعة الخامسة ، - م: GEOTAR-Media ، 2009.
8) Polyanskaya A.S.، Sheveleva A.O. التطوير المنهجيعلى العمل المخبري: "الأحماض الأمينية" و "البروتينات". ، 1976 ، 37 ص. المورد الإلكتروني
استضافت على Allbest.ru
وثائق مماثلة
التركيب والخصائص الأساسية للبروتينات ودورها في الحياة البرية. التركيب المكاني للبروتينات. ردود الفعل النوعية على البروتينات. تكوين جلطات دموية أثناء تجلط الدم. مكونات بروتين الدم. عملية تكوين وتجلط الكازين.
عرض تقديمي ، تمت إضافة 10/01/2012
هيكل و الخصائص العامةالأحماض الأمينية وتصنيفها وتفاعلاتها الكيميائية. هيكل جزيء البروتين. الخصائص الفيزيائية والكيميائية للبروتينات. عزل البروتينات وترسيخ تجانسها. التوصيف الكيميائي للأحماض النووية. هيكل الحمض النووي الريبي.
دورة محاضرات أضيفت بتاريخ 12/24/2010
العناصر الكيميائية الرئيسية التي تتكون منها البروتينات. البروتينات عبارة عن بوليمرات يكون مونومراتها أحماض أمينية. تركيب الأحماض الأمينية ، مستويات تنظيم جزيئات البروتين. هياكل البروتين ، الخصائص الأساسية للبروتينات. تمسخ البروتين وأنواعه.
عرض تقديمي ، تمت إضافة 01/15/2011
تقييم الهيكل الإداري الإقليمي الحالي لروسيا. أبحاث البروتين. تصنيف البروتينات. التكوين والهيكل. الكيميائية و الخصائص الفيزيائية. التوليف الكيميائي للبروتينات. قيمة البروتينات.
الملخص ، تمت الإضافة في 04/13/2003
الخصائص العامة للبروتينات وتصنيفها وهيكلها وتركيبها. التحلل المائي للبروتينات مع الأحماض المخففة ، تفاعلات الألوان للبروتينات. أهمية البروتينات في الطبخ و منتجات الطعام. حاجة جسم الإنسان وهضمه للبروتين.
ورقة مصطلح ، تمت إضافة 10/27/2010
البروتينات هي مركبات طبيعية كبيرة الجزيئات تتكون من بقايا الأحماض الأمينية المرتبطة بروابط الببتيد. التركيب النوعي للبروتينات وهيكلها ووظائفها. عمليات التحلل المائي (الحمضي القاعدي ، الأنزيمي) وتمسخ البروتين.
عرض تقديمي ، تمت إضافة 02/11/2015
دور في الحياة البرية. تكوين وخصائص البروتينات. تصنيف البروتينات. تحديد بنية البروتينات. تحديد وجود البروتين. تحديد البروتينات والببتيدات. توليف الببتيدات. الإنتاج الاصطناعي للبروتين. أحماض أمينية.
الملخص ، تمت الإضافة في 12/01/2006
مستويات التركيب والتكديس لجزيئات البروتين والتشكيل. توصيف وظائف البروتينات في الجسم: الهيكلية ، التحفيزية ، المحركات ، النقل ، التغذية ، الحماية ، المستقبلات ، التنظيمية. تركيب وخصائص وأنواع وتفاعلات الأحماض الأمينية.
الملخص ، تمت الإضافة في 03/11/2009
البروتينات هي مواد عضوية تحتوي على نسبة عالية من النيتروجين ، جزيئاتها مبنية من بقايا الأحماض الأمينية. معلومات وراثيةالموجود في جزيء الحمض النووي. تحمل البروتينات معلومات وراثية. تصنيف الأحماض الأمينية.
الملخص ، تمت الإضافة في 01/17/2009
مفهوم ومؤسسي كيمياء البروتين. التكوين ، مستوى التنظيم ، بنية البروتين. تمسخ ، تفاعل بيوريت ، تحلل البروتين. بروتينات كاملة وغير كاملة. البروتينات والدهون والكربوهيدرات هي أساس التغذية وكميتها الضرورية للإنسان.




